Periodni sistem elemenata
Periodni sistem elemenata je tabelarni prikaz hemijskih elemenata, organizovanih na osnovu njihovih atomskih brojeva (broja protona u jezgru), elektronskoj konfiguraciji i ponavljajućim hemijskim osobinama.[1][2][3] Elementi su poređani po rastućem atomskom broju, koji se obično navodi sa hemijskim simbolom u svakom polju. Standarni oblik tabele se sastoji od mreže elemenata poređanih u 18 kolona i 7 redova, sa dva reda elemenata ispod te tabele. Tabela se može podeliti na četiri pravougaona bloka: s-blok nalevo, p-blok nadesno, d-blok u sredini i f-blok ispod njega.
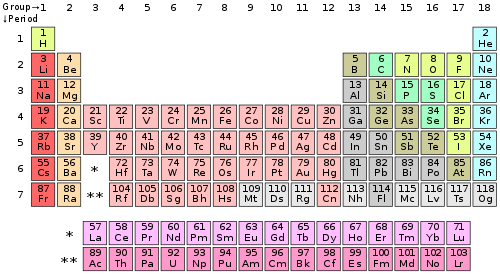
Vrste tabele se nazivaju periode, a kolone se nazivaju grupe, a neke od kolona imaju posebna imena kao što su halogeni elementi ili plemeniti gasovi. Pošto je po definiciji periodni sistem zasnovan na ponavljajućim trendovima, svaka takva tabela se može koristiti da se dobiju veze između osobina elemenata i predvide osobine novih, još neotkrivenih ili sintetizovanih elemenata. Zbog toga periodni sistem elemenata, bez obzira da li je u standarnom obliku ili u nekoj drugoj varijanti, pruža koristan okvir za analizu hemijskog ponašanja i široko se upotrebljava u hemiji i u drugim naukama.
Iako su postojale prethodnice periodnog sistema, Dmitriju Mendeljejevu se uglavnom pripisuju zasluge za objavljivanje prve tabele široko priznatog periodnog sistema elemenata 1869. godine. On je razvio svoj periodni sistem da ilustruje periodične trendove u osobinama tada poznatih elemenata. Mendeljejev je takođe predvideo neke osobine tada nepoznatih elemenata od kojih se očekivalo da popune rupe u njegovoj tabeli. Većina njegovih predviđanja se pokazala tačnom kada su dotični elementi kasnije otkriveni. Mendeljejevljev periodni sistem je od tada proširivan i poboljšan otkrićem ili sintetizovanjem novih elemenata i razvojem novih teoretskih modela za objašnjenje hemijskih odlika.
Svi elementi od atomskih brojeva 1 (vodonik) do 118 (ununoktijum) su otkriveni ili navodno sintezizovani, dok se elementi 113, 115, 117 i 118 još uvek moraju potvrditi. Prvih 98 elemenata postoje u prirodi, mada se neki mogu pronaći samo u tragovima ili su sintetizovani u laboratorijama pre nego što su pronađeni u prirodi. Elementi sa atomskim brojevima od 99 do 118 su samo sintetizovani ili se tvrdi da su sintetizovani. Dobijanje elemenata koji imaju veće atomske brojeve je izazov, dok se postavlja pitanje koliko se periodni sistem elemenata može modifikovati da se zadovolje bilo kakvi novi dodaci.
Pregled uredi
| grupa → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| perioda ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo | ||
| * lantanoidi | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** aktinoidi | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| alkalni metali | zemno-alkalni metali | lantanoidi | aktinoidi | prelazni metali |
| slabi metali | metaloidi | nemetali | halogeni elementi | plemeniti gasovi |
Značenje boja atomskih brojeva:
- Elementi numerisani brojem obojenim u plavu boju su u tečnom agregatnom stanju na standardnoj temperaturi i standardnom pritisku (STP).
- numerisani brojem obojenim u zeleno su gasovitom agregatnom stanju na STP;
- numerisani brojem obojenim u crno su u čvrstom agregatnom stanju na STP;
- numerisani brojem obojenim u crveno su veštački (svi su u čvrstom agregatnom stanju na STP).
- numerisani brojem obojenim u sivo još uvek nisu otkriveni (takođe imaju posvetljenu boju koja prikazuje u koju grupu hemijskih elemenata spadaju).
Sve verzije periodnog sistema obuhvataju samo hemijske elemente, a ne smeše jedinjenja, ili subatomske čestice.[n 1] Svaki hemijski element ima jedinstveni atomski broj koji označava broj protona u njegovom jezgru. Većina elemenata ima različite brojeve neutrona u različitim atomima, pri čemu se te varijante nazivaju izotopima. Na primer, ugljenik ima tri prirodna izotopa: svi njegovi atomi imaju šest protona i većina ima šest neutrona, ali oko jednog procenta ima sedam neutrona, i veoma mala frakcija ima osam neutrona. Izotopi se nikad ne razdvajaju u periodnom sistemu; oni se uvek zajedno grupišu kao jedan element. Elementi koji nemaju stabilne izotope imaju atomske mase najstabilnijih izotopa, i takve mase su navedene u zagradama.[4]
U standardnom periodnom sistemu, elementi su poređani po atomskom broju (broju protona u jezgru atoma). Novi red (perioda) se počinje kad nova elektronska ljuska ima svoj prvi elektron. Kolone (grupe) su određene elektronskom konfiguracijom atoma; elementi sa istim brojem elektrona u određenoj podljusci padaju u iste kolone (e.g. kiseonik i selen su u istoj koloni zato što oba imaju četiri elektrona u krajnjoj p-podljusci). Elementi sa sličnim hemijskim svojstvima generalno padaju u istu grupu periodnog sistema, mada u f-bloku, i donekle u d-bloku, elementi u istoj periodi isto tako imaju slična svojstva. Stoga je relativno lako da se predvide hemijske osobine elementa ako se znaju svojstva jednog od elemenata u njegovoj blizini.[5]
Godine 2014. periodni sistem je imao 114 potvrđena elementa, čime su obuhvaćeni: 1 (vodonik) do 112 (kopernicijum), 114 (flerovijum) i 116 (livermorijum). Elementi 113, 115, 117 i 118 su navodno sintetizovani u laboratorijama međutim te tvrdnje nisu zvanično potvrđene od strane Međunarodne unije za čistu i primenjenu hemiju (IUPAC), niti su im data imena. Kao takvi ovi elementi su trenutno nazivaju po njihovom atomskim brojevima (e.g., "element 113"), ili njihovim provizionim sistematskim imenima ("ununtrijum", simbol "Uut").[6]
Ukupno 98 elemenata se prirodno javlja; preostalih 16 elemenata, od ajnštajnijuma do kopernicijuma, i flerovium i livermorijum, se javljaju samo nakon laboratorijske sinteze. Od 98 prirodnih elemenata, 84 su primordijalna. Drugih 14 prirodnih elemenata se javljaju jedino u lancu raspadanja primordijalnih elemenata.[7] Element teži od ajnštajnijuma (elementa 99) nikad nije uočen u makroskopskim količinama u svojoj čistoj formi.[8]
Varijante rasporeda uredi
| Periodic table layouts | |
|---|---|
| Lantanoidi i aktinoidi su odvojeni (levo; 18 kolona) i u glavnoj tabeli (desno; 32 kolone) | |
U većini grafičkih prezentacija periodnog sistema, glavna tabela ima 18 kolona i lantanoidi i aktinoidi su prikazani kao dva dodatna reda ispod glavne tabele,[9] sa dva rezervisana mesta prikazana u glavnoj tabeli, između barijuma i hafnijuma, i radijuma i raderfordijuma, respektivno. Ovi držači mesta mogu dda budu markeri poput asteriska, ili sažeti opisi elemenata ("57–71"). Ta konvencija je u potpunosti stvar praktičnog formatiranja. Ista struktura tabele može da bude prikazana u formatu sa 32 kolone, pri čemu su lantanidi i aktinoidi u redovima 6 i 7 glavne tabele.
Međutim, na bazi hemijskih i fizičkih svojstava elemenata mogu se konstruisati tabele sa mnoštvom alternativnih struktura.
Metodi grupisanja uredi
Grupe uredi
Grupa ili familija je vertikalna kolona u periodnom sistemu. Grupe obično imaju značajnije periodične trendove od perioda i blokova, kao što je objašnjeno u daljem tekstu. Moderne kvantno mehaničke teorije atomskih struktura objašnjavaju trendove grupa činjenicom da elementi unutar iste grupe generalno imaju iste elektronske konfiguracije u njihovoj valentnoj ljusci.[10] Konsekventno, elementi u istoj grupi imaju slična hemijska svojstva i manifestuju jasan trend u osobinama sa porastom atomskog broja.[11] Međutim u nekim delovima periodnog sistema, kao što su d-blok i f-blok, horizontalne sličnosti mogu da budu jednako važne, ili više izražene od vertikalnih sličnosti.[12][13][14]
Po međunarodnoj imenskoj konvenciji, grupe se numerišu od 1 do 18 sa leve strane (od alkalnih metala) do krajnje desne kolone (plemenitih gasova).[15] Ranije su bili korišćeni rimski brojevi. U Americi, rimskim brojevima je dodavano "A" ako je grupa u s- ili u p-bloku, ili "B" ako je grupa u d-bloku. Rimski brojevi su odgovarali zadnjoj cifri u današnjoj imenskoj konvenciji (e.g. elementi grupe 4 su bili grupa IVB, a elementi grupe 14 su bili grupa IVA). U Evropi je korišteno slično obeležavanje, izuzev da je "A" korišćeno ako je grupa bila pre grupe 10, a "B" je korišteno za grupe uključujući i iza grupe 10. Dodatno grupe 8, 9 i 10 su tretirane kao triplet-grupa , kolektivno poznata u obe notacije kao grupa VIII. Godine 1988, novi IUPAC imenski sistem je ušao u upotrebu, i ranije korištena imena grupa su postala zastarela.[16]
Nekim od tih grupa su data trivijalna (nesistematska) imena, kao što je prikazano u donjoj tabeli, mada se pojedina retko koriste. Grupe 3–10 nemaju trivijalna imena i oslovljavaju se jednostavno po njihovim grupnim brojevima ili po imenu prvog člana grupe (kao što je 'scandijumova grupa' za Grupu 3), pošto one pozuju sličnosti i/ili vertikalne trendove u manjoj meri.[15]
Elementi u istoj grupi obično slede patern u pogledu atomskog radijusa, energije jonizacije, i elektronegativnosti. Idući od gore nadole u grupi, atomski radijusi elemenata se povećavaju. Pošto broj popunjenih energijskih nivoa raste, valentni elektroni se nalaze sve dalje od nukleusa. Idući od gore na dole, svaki sukcesivni element ima sve manju energiju jonizacije jer je lakše da se ukloni elektron. Slično tome, elementi grupe imaju idući od gore na dole sve manju elektronegativnost usled povećanja rastojanja imeđu valentnih elektrona i nukleusa.[17] Postoje izuzeci tih trendova, na primer u grupi 11 gde se elektronegativnost povećava idući naniže.[18]
| Grupe u periodnom sistemu | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Broj grupe[1] | 1 | 2 | 3[2] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Mendeljejev (I–VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | [3] | ||||
| CAS (SAD, patern A-B-A) |
IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||
| old IUPAC (Evropa, patern A-B) |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | ||||
| Trivijalno ime | Alkalni metali | Zemnoalkalni metali | Kovni metali[4] | Isparljivi metali[5] | Ikosageni[6] | Kristalogeni[7] | Pniktogeni | Halkogeni | Halogeni | Plemeniti gasovi | ||||||||||
| Ime po elementu | Litijumova grupa | Berilijumova grupa | Skandijumova grupa | Titanova grupa | Vanadijumova grupa | Hromova grupa | Manganova grupa | Gvožđeva grupa | Kobaltova grupa | Niklova grupa | Bakrova grupa | Cinkova grupa | Borova grupa | Uglenikova grupa | Azotova grupa | Kiseonikova grupa | Fluorova grupa | Helijumova ili Neonova grupa | ||
| Perioda 1 | H[8] | He | ||||||||||||||||||
| Perioda 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||
| Perioda 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| Perioda 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| Perioda 5 | Rb | Sr | [9] | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Perioda 6 | Cs | Ba | La–Yb | Lu[10] | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Perioda 7 | Fr | Ra | Ac–No | Lr[11] | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| a Trenutni, moderni IUPAC brojevi grupa. | ||||||||||||||||||||
| b Mada oni nisu bili uvršteni u Mendeljejevu originalnu tabelu, Mendeljev je kasnije (1902) prihvatio evidenciju za postojanje plemenitih gasova, i stavio ih je u zasebnu "grupu 0". | ||||||||||||||||||||
| c Vodoni (H), mada je stavljen u koloni 1, ne pripada alkalnim metalima. | ||||||||||||||||||||
| d Grupa 3: u zavisnosti od izvora, lutecijum (Lu) i lorencijum (Lr) mogu da budu uvršteni; lantanijum (La) i aktinijum (Ac) mogu da budu uvršteni; f-blok (sa 15 lantanida i 15 aktinoida) može da bude uvršten. | ||||||||||||||||||||
| e Ovo ime grupe nije preporučio IUPAC. | ||||||||||||||||||||
Periode uredi
Perioda je horizontalni red u periodnoj tabeli. Mada grupe generalno imaju značajnije periodične trendove, postoje regioni gde su horizontalni trendovi značajniji od trendova vertikalnih grupa, kao što je f-blok, u kom slučaju lantanoidi i aktinoidi formiraju dve znatne horizontalne serije elemenata.[19]
Elementi u istoj periodi ispoljavaju tredove u pogledu atomskog radijusa, energije jonizacije, afiniteta elektrona, i elektronegativnosti. Krečući se sa leva na desno duž periode, atomiski radius se obično snižava. Do toga dolazi zato što svaki sukcesivni element ima dodatni proton i elektron što ima za posledicu približavanje elektrona nukleusu.[20] Smanjenje atomskog radijusa uzrokuje povišenje energije jonizacije idući s leva na desno duž periode. Što čvršće je element vezan to je više energije potrebno za uklanjanje elektrona. Elektronegativnost se povišava u istom maniru kao i energija jonizacije, zbog privlačenja elektrona od strane nukleusa.[17] Afinitet elektrona takođe pokazuje izvestan trend duž periode. Metali (na levoj strani periode) generalno imaju niži elektronski afinitet od nemetala (na desnoj strani periode), sa izuzetkom plemenitih gasova.[21]
Blokovi uredi
Specifični regioni periodnog sistema se nazivaju blokovima u skladu sa redosledom u kom su elektronske ljuske elemenata popunjene. Blokovi su nazvani po podljusci u kojoj „zadnji“ elektron teoretski boravi.[22][n 2] s-blok se sastoji od prve dve grupe (alkalnih i zemnoalkalnih metala), kao i vodonika i helijuma. p-blok se sastoji od zadnjih šest grupa, što su grupe 13 do 18 po IUPAC notaciji i sadrži između ostalog, sve metaloide. d-blok se sastoji od grupa 3 do 12 i sadrži sve prelazne metale. f-blok, koji se često prikazuje ispod ostatka periodnog sistema, ne sadrži numerisane grupe i obuhvata lantanoide i aktinoide.[23]
Metali, metaloidi i nemetali uredi
Na osnovu zajedničkih fizičkih i hemijskih svojstava, elementi se mogu klasifikovati u nekoliko kategorija: metali, metaloidi i nemetali. Metali su u opštem slučaju sjajne, visoko provodne čvrste materije koje formiraju legure jedan s drugim, i jonska jedinjenja (soli) sa nemetalima (izuzev plemenitih gasova). Većina nemetala su obojeni ili bezbojni izolacioni gasovi; nemetali koji formiraju jedinjenja sa drugim nemetalima čine to putem kovalentnog vezivanja. Između metala i nemetala su metaloidi, koji imaju srednja ili mešovita svojstva.[24]
Metali i nemetali se dalje mogu klasifikovati u potkategorije koje pokazuju gradijent od metalnih do nemetalnih svojstava, idući s leva na desno u periodnom redu. Metali se dalje dele u visoko reaktivne alkalne metale, manje reaktivne zemljoalkalne metale, lantanoide i aktinoide, arhetipske prelazne metala, i fizički i hemijski slabe post-tranzicione metale. Nemetali se jednostavno dele u poliatomske nemetale, koji pošto su najbliži metaloidima pokazuju donekle metalni karacter; diatomske nemetale, koji su esencijalno nemetalni; i monatomske plemenite gasove, koji su nemetalni i skoro kompletno inertni. Specijalizovana grupiranja kao što su refraktorni metali i plemeniti metali, koja su podskup (u ovom slučaju) prelaznih metala, su isto tako poznata[25] i povremeno korišćena.[26]
Svrstavanje elemenata u kategorije i potkategorije na bazi zajedničkih svojstava je imperfektno. Postoji ceo spektar svojstava u svakoj kategoriji i nije teško naći preklapanja na granicama, kao što je to slučaj i sa mnogim drugim klasifikacionim šemama.[27] Berilijum se, na primer, klasifikuje kao zemnoalkalni metal, mada njegova amfoterna hemija i tendencija da uglavnom formira kovalentna jedinjenja su atributi hemijski slabih ili post-tranzicionih metala. Radon se klasifikuje kao nemetal i plemeniti gas, iako on ima donekle katjonsku hemiju, koja je karakteristična za metale. Druge klasifikacione šeme su moguće, kao što je podela elemenata u mineraloške pojavne kategorije, ili kristalizacione strukture. Kategorisanje elemenata na ovaj način datira još od 1869, kad je Hinrichs[28] napomenuo da jednostavne granične linije mogu da budu povučene u periodnom sistemu radi označavanja elemenata sa sličnim svojstvima, kao što su metali i nemetali, ili gasoviti elementi.
Periodni trendovi uredi
Elektronska konfiguracija uredi
Elektronska konfiguracija ili organizacija elektrona koji orbitiraju neutralne atome ispoljava ponavljajući patern ili periodičnost. Elektroni okupiraju serije elektronskih ljuski (numerisanih kao ljuska 1, ljuska 2, itd). Svaka ljuska se sastoji od jedne ili više orbitala (imenovanih s, p, d, f i g). Sa porastom atomskog broja, elektroni progresivno popunjavaju te nivoe i orbitale, manje ili više sledeći Madelungovo pravilo ili pravilo energetskog uređivanja, kao što je prikazano na dijagramu. Elektronska konfiguracija neona, na primer, je 1s2 2s2 2p6. Sa atomskim brojem deset, neon ima dva elektrona na prvom nivou, i osam elektrona na drugom nivou — dva u s orbitali i šest u p orbitali. S perspektive periodnog sistema, kad prvi put elektron zauzme novi nivo, započinje se nova perioda. Takve pozicije su zauzete vodonikom i alkalnim metalima.[29][30]
Pošto su svojstva elementa uglavnom određena njegovom elektronskom konfiguracijom, osobine elemenata takođe imaju ponavljajuće ili periodične trendove. Neki primeri toga su prikazani na donjim dijagramima za atomske radijuse, energiju jonizacije i elektronski afinitet. Manifestacije tih periodičnih svojstava su bile poznate daleko pre razvoja teorije, i one su dovele do formulisanja zakona periodičnosti (ponavljanja svojstava elemenata u varirajućim intervalima) i formulisanja prvih periodnih sistema.[29][30]
Atomski radijusi uredi
Atomski radijusi variraju u predvidivom i objašnjivom maniru duž periodnog sistema. Na primer, radijusi se generalno smanjuju duž periode u tabeli, idući od alkalnih metala do plemenitih gasova; i povećavaju se idući niz grupe. Radius se naglo povećava nakon plemenitog gasa na kraju svake periode i alkalnog metala na početku sledeće periode. Ovi trendovi atomskih radijusa (i raznih drugih hemijskih i fizičkih svojstava elemenata) se mogu objasniti teorijom elektronskih nivoa atoma; oni pružaju značajnu evidenciju za razvoj i potvrđivanje kvantne teorije.[31]
Elektroni u na 4f-podnivou, koji se progresivno popunjava idući od cerijuma (elementa 58) do iterbijuma (elementa 70), nisu posebno efektivni u zaštićivanju rastućeg nuklearnog naelektrisanja iz isturenijih podnivoa. Elementi neposredno iza lantanoida imaju atomske radijuse koji su manji nego što bi očekivalo i koji su skoro identični sa atomskim radijusima elemenata neposredno iznad njih.[32] Stoga hafnijum ima virtualno isti atomski radijus (i hemijska svojstva) kao cirkonijum, i tantal ima atomski radijus sličan niobijumu, i tako dalje. Ova pojava je poznata kao lantanoidna kontrakcija. Efekat lantanidne kontrakcije je primetan do platine (elementa 78), nakon čega je maskiran relativističkim efektom poznatim kao efekat inertnog para.[33] Kontrakcija d-bloka, koja je slična efektu između d-bloka i p-bloka, je manje izražena nego lantanoidna kontrakcija, mada proizilazi iz sličnih uzroka.[32]
Energija jonizacije uredi
Prva energija jonizacije je energija koja je neophodna za uklanjanje prvog elektrona iz atoma, druga energija jonizacije je energija neophodna za uklanjanje drugog elektrona iz atoma, itd. Za dati atom, sukcesivne energije jonizacije se povećavaju sa stepenom jonizacije. Veliki skokovi u uzastopnim molarnim energijama jonizacije se javljaju pri uljanjanju elektrona iz konfiguracije plemenitih gasova (kompletiranih elektronskih ljuski). Za magnezijum na primer, prva energija jonizacije je 738 kJ/mol, a druga je 1450 kJ/mol. Prve dve molarne energije jonizacije magnezijuma se odnose na uklanjanje dva 3s elektrona, a treća energija jonizacije bi bila daleko veća 7730 kJ/mol, jer bi se odstanjivao 2p elektron iz veoma stabilne konfiguracije Mg2+ jona, koja je slična neonu. Istovetni skokovi se javljaju u energijama jonizacije u drugih atoma treće periode.[33]
Elektroni u bližim orbitalama su izloženi većim silama elektrostatičkog privlačenja; tako da je za njihovo uklanjanje potrebno više energije. Energija jonizacije se povećava idući na gore i na desno u periodnom sistemu.[33]
Elektronegativnost uredi
Elektronegativnost je tendencija atoma da privlači elektrone.[34] Elektonegativnost atoma je zavisna od njegovog atomskog broja i rastojanaja između valentnih elektrona i nukleusa. Što je veća njegova elektronegativnost, to više element privlači elektrone. Ovo svojstvo je prvi predložio Linus Pauling 1932. godine.[35] U opštem slučaju, elektronegativnost se povećava idući s leva na desno duž periode, i smanjuje se spuštanjem niz grupe. Fluor najelektronegativniji element,[n 4] dok je cezijum najmanje elektronegativan, bar među elementima sa znatnom količinom dostupnih podataka.[18]
Postoje neki izuzeci od ovog opšteg pravila. Galijum i germanijum imaju veću elektronegativnost od aluminijuma i silicijuma respektivno, zbog kontrakcije d-bloka. Elementi četvrte periode neposredno nakon prvog reda prelaznih metala imaju neobično male atomske radijuse zato što 3d - elektroni nisu efektivni u zaštićivanju naelektrisanja nukleusa, i manja veličina atoma je u korelaciji sa povećanom elektronegativnošću.[18] Anomalno visoka elektronegativnost olova, posebno u odnosu na talijum i bizmut, čini se da je artefakt selekcije podataka (i dostupnosti podataka) — metode računja, izuzev Polingovog metoda, pokazuju normalne periodične trendove za ove elemente.[36]
Elektronski afinitet uredi
Elektronski afinitet atoma je količina energije koja se oslobodi dodavanjem elektrona u neutralni atom, čime se formira negativni jon. Mada elektronski afinitet znatno varira, izvesni obrasci su primetni. Generalno, nemetali imaju pozitivnije vrednosti elektronskog afiniteta od metala. Hlor najjače privlači dodatni elektron. Elektronski afiniteti plemenitih gasova nisu nepobitno izmereni, tako da oni možda imaju neznatno negativne vrednosti.[39]
Elektronski afinitet se generalno povećava duž periode. To je uzrokovano popunjavanjem valentne ljuske atoma; atom grupe 17 otpušta više energije od atoma grupe 1 pri zadobijanju elektrona, zato što dobija popunjenu valentnu ljusku i stoga je stabilniji.[39]
Trend smanjivanja elektronskog afiniteta idući niz grupe je logičan. Dodatni elektron ulazi u orbitale koje su udaljenije od nukleusa. Kao takav taj elektron u manjoj meri privlači nukleus i manje energije se otpušta njegovim dodavanjem. Međutim, pri kretanju nih grupe, oko jedne trećine elemenata pokazuje anomalna svojstva, pri čemu teži elementi imaju veće elektronske afinitete od njihovih susednih lakših kongenera. Ta pojava je uglavnom posledica nedovoljnog zaštićivanja d i f elektronima. Uniformno smanjenje elektronskog afiniteta je primetno jedino u 1. grupi atoma.[40]
Metalni karakter uredi
Što je niža vrednost energije jonizacije, elektronegativnosti i elektronskog afiniteta, to u većoj meri element ima metalni karakter. Nasuprot tome, nemetalni karakter se povećava sa povećanjem vrednosti tih svojstava.[41] Imajući u vidu periodične trendove te tri osobine, metalni karakter ima tendeciju opadanja duž periode (ili reda). Postoje izvesne iregularnosti, uglavnom zbog slabe zaštite nukleusa d i f elektronima, i relativističkih efekata.[42] Elementi sa najizraženijim metalnim karakterom (poput cezijuma i francijuma) su u donjem levom uglu periodnog sistema, a nemetalni elementi (kiseonik, fluor, hlor) su prevashodno u gornjem desnom uglu. Kombinacija horizontalnih i vertikalnih trendova u ispoljavanju metalnog karaktera objašnjava rebrastu liniju podele između metala i nemetala u nekim periodnim sistemima, i praksu da se ponekad elementi pored te linije smatraju metaloidima.[43][44]
Istorija periodnog sistema hemijskih elemenata uredi
Iako je sastavljanje periodnog sistema nešto što se rutinski pripisuje Mendeljejevu, periodizacija i sistematizacija elemenata ima znatno dužu istoriju.[1][2][3]
Već u 17. veku, tačnije 1661. godine, Robert Bojl je poređao tada poznatih 13 elemenata po rastućoj relativnoj atomskoj masi, dok će ovaj sistem proširiti Lavoazje sa dodatnih 11 elemenata.
Za ovo vreme značajna otkrića na polju hemije i fizike, omogućila su otkrivanje i imenovanje novih elemenata, tako da je potreba za klasifikacijom tog rastućeg broja poznatih elemenata postajala sve očiglednija. Johan Debernajer, kao odgovor na ovu potrebu, formira sistem elemenata koji su bili poređani u trijade, po zajedničkim osobinama, i tako da relativna atomska masa srednjeg elementa trijade bude aritmetička sredina gornjeg i donjeg. Sličnu sistematizaciju dao je i francuz de Šakankurtua, koji je došao na ideju da elemente, po rastućoj relativnoj atomskoj masi poređa u spiralu obmotanu oko valjka.
Svakako najozbiljni pomak ka današnjem periodnom sistemu, pre Mendeljeva dao je Džon Njulends koji je prema ugledu na muzičke oktave, dao periodni sistem sa elementima poređanim u oktave, tako da se osobine periodično ponavljaju nakon svakih 7 elemenata. U vertikalnim kolonama, elementi su bili poređani po porastu Ar, dok su horizontalne vrste bile uslovljene sličnošću u osobinama.
Ipak rad Mendeljejeva na periodzaciji elemenata ostao je zapamćen kao najvažniji, nemalo zato što je njegovo rešenje periodnog sistema zaista bilo najadekvatnije. 1869. on daje prvu verziju periodnog sistema sa rasporedom elemenata sličnim onom kod Njulendsa. Ovakav raspored Mendeljejev je uslovio zakonom periodičnosti koji je dao po kome su fizičke i hemijske osobine elemenata periodične funkcije njihove relativne atomske mase.
1871. Mendeljev daje drugu, reformisanu verziju periodnog sistema koja se temeljila na izmeni koju je Mendeljejev napravio u zakonu periodičnosti. Naime, on je primetio da su osobine hemijskih elemenata zapravo periodične funkcije njihovih rednih brojeva. Reformisani periodni sistem imao je elemente podeljene u vertikalne nizove - grupe - koje su sadržale elemente sličnih osobina i horizontalne nizove - periode - koje su imale elemente poređane po rastućem rednom broju, i u kojima su su osobine iz prethodnog niza periodično ponavljale. Grupa je u početku bilo 8, prvih 7 su imale podgrupe dok je osma bila podeljena u trijade. Perioda je bilo sedam, i sistem nije sadržao plemenite gasove. Mendeljejev je takođe predvideo postojanje elemenata sa drugim atomskim masama koji još nisu bili otkriveni, ali je na osnovu zakona periodičnosti za njih ostavio odgovarajuća mesta.
Danas se ova periodičnost objašnjava periodičnošću javljanja sličnih elektronskih konfiguracija u odgovarajućim atomima.
Napomene uredi
- ↑ Neke tabele sadrže element nulu (i.e. szostancuja koja se sastoji samo od neutrona), mada to nije uobičajeno. Pogledajte na primer Hemijsku galakciju Filipa Stjuarta.
- ↑ Postoje jedna nedosljednost i neke nepravilnosti u ovoj konvenciji. Na primer, helijum je prikazan da je u p-bloku mada je zapravo element s-bloka, i d-podljuska u d-bloku je zapravo popunjena kad se dosegne grupa 11, umesto grupe 12.
- ↑ Plemeniti gasovi, astat, francijum, i svi elementi teži od americijuma su izostavljeni, jer podaci o njim nisu dostupni.
- ↑ Dok je fluor najelektronegativniji element po Paulingovoj skali, dok je neon najelektronegativniji element po drugim skalama, kao što je Alenova skala.
Reference uredi
- ↑ 1,0 1,1 Housecroft C. E., Sharpe A. G. (2008). Inorganic Chemistry (3rd izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ↑ 2,0 2,1 Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑ 3,0 3,1 Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0-911910-13-1.
- ↑ Greenwood, pp. 24–27
- ↑ Gray, p. 6
- ↑ Koppenol, W. H. (2002). „Naming of New Elements (IUPAC Recommendations 2002)” (PDF). Pure and Applied Chemistry 74 (5): 787–791. DOI:10.1351/pac200274050787.
- ↑ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New izd.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Haire, Richard G. (2006). „Fermium, Mendelevium, Nobelium and Lawrencium”. u: Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd izd.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ↑ Gray, p. 11
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. str. 32. ISBN 0-7637-7833-8.
- ↑ Bagnall, K. W. (1967). „Recent advances in actinide and lanthanide chemistry”. u: Fields, P.R.; Moeller, T.. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry. 71. American Chemical Society. str. 1–12. DOI:10.1021/ba-1967-0071. ISBN 0-8412-0072-6.
- ↑ Day, M. C., Jr.; Selbin, J. (1969). Theoretical inorganic chemistry (2nd izd.). New York: Nostrand-Rienhold Book Corporation. str. 103. ISBN 0-7637-7833-8.
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (5th izd.). Walton-on-Thames: Nelson Thornes. str. 40. ISBN 0-17-448276-0.
- ↑ 15,0 15,1 Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ↑ Fluck, E. (1988). „New Notations in the Periodic Table”. Pure and Applied Chemistry (IUPAC) 60 (3): 431–436. DOI:10.1351/pac198860030431. Pristupljeno 24 March 2012.
- ↑ 17,0 17,1 Moore, p. 111
- ↑ 18,0 18,1 18,2 Greenwood, p. 30
- ↑ Stoker, Stephen H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. str. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ↑ Mascetta, Joseph (2003). Chemistry The Easy Way (4th izd.). New York: Hauppauge. str. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ↑ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (7th izd.). Belmont: Thomson Brooks/Cole. str. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ↑ Gray, p. 12
- ↑ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. str. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (4th izd.). New York: McGraw-Hill. str. 536. ISBN 0-07-111658-3.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. str. 376. ISBN 0-87170-825-6.
- ↑ Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. str. 8. ISBN 978-3-540-88545-0.
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. str. 169–71. ISBN 978-0-521-19436-5.
- ↑ Hinrichs, G. D. (1869). „On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations”. Proceedings of the American Association for the Advancement of Science 18 (5): 112–124.
- ↑ 29,0 29,1 Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. str. 61–67. ISBN 0-313-31664-3.
- ↑ 30,0 30,1 Chang, Raymond (2002). Chemistry (7 izd.). New York: McGraw-Hill. str. 289–310; 340–42. ISBN 0-07-112072-6.
- ↑ Greenwood, p. 27
- ↑ 32,0 32,1 Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd izd.). McGraw-Hill. str. 22. ISBN 978-0-07-112651-9.
- ↑ 33,0 33,1 33,2 Greenwood, p. 28
- ↑ Međunarodna unija za čistu i primenjenu hemiju. "Electronegativity". Kompendijum Hemijske Terminologije Internet edition.
- ↑ Pauling, L. (1932). „The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms”. Journal of the American Chemical Society 54 (9): 3570–3582. DOI:10.1021/ja01348a011.
- ↑ Allred, A. L. (1960). „Electronegativity values from thermochemical data”. Journal of Inorganic and Nuclear Chemistry (Northwestern University) 17 (3–4): 215–221. DOI:10.1016/0022-1902(61)80142-5. Pristupljeno 11 June 2012.
- ↑ Huheey, Keiter & Keiter, p. 42
- ↑ Siekierski, Slawomir; Burgess, John (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. str. 35‒36. ISBN 1-898563-71-3.
- ↑ 39,0 39,1 Chang, pp. 307–309
- ↑ Huheey, Keiter & Keiter, pp. 42, 880–81
- ↑ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (2nd izd.). Harcourt Brace Jovanovich. str. 58. ISBN 0-15-506465-7.
- ↑ Huheey, Keiter & Keiter, pp. 880–85
- ↑ Sacks, O (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. str. 191, 194. ISBN 0-375-70404-3.
- ↑ Gray, p. 9
Literatura uredi
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 0-19-284100-9.
- Chang, Raymond (2002). Chemistry (7th izd.). New York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1.
- Gray, Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Greenwood, Norman N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon. DOI:10.1002/crat.2170200510. ISBN 0-08-022057-6.
- Huheey, JE; Keiter, EA; Keiter, RL (1993). Principles of structure and reactivity (4th izd.). New York: Harper Collins College Publishers. ISBN 0-06-042995-X.
- Moore, John (2003). Chemistry For Dummies. New York: Wiley Publications. str. 111. ISBN 978-0-7645-5430-8. OCLC 51168057.
- Scerri, Eric (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 0-19-530573-6.
- Scerri, Eric R. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- Venable, F P (1896). The development of the periodic law. Easton PA: Chemical Publishing Company.
- Ekkhard Fluck, Klaus G. Heumann: Periodensystem der Elemente: physikalische Eigenschaften; [chemische, biologische und geologische Eigenschaften], 5. Auflage, Wiley-VCH, Weinheim 2012, ISBN 978-3-527-33285-4, ISBN 3-527-33285-5.
- Periodensystem interaktiv! (CD-ROM für Windows und Mac OS X), Welsch & Partner, Tübingen K. Seubert, "Das natürliche System der Elemente von Lothar Meyer u. D. Mendelejew", Ostwalds Klassiker der exakten Wissenschaften" Bd. 68, 1895 (Nachdruck 1990)
- Ekkhard Fluck, Klaus G. Heumann: Periodensystem der Elemente: physikalische Eigenschaften; [chemische, biologische und geologische Eigenschaften], 5. Auflage, Wiley-VCH, Weinheim 2012, ISBN 978-3-527-33285-4, ISBN 3-527-33285-5.
- Periodensystem interaktiv! (CD-ROM für Windows und Mac OS X), Welsch & Partner, Tübingen K. Seubert, "Das natürliche System der Elemente von Lothar Meyer u. D. Mendelejew", Ostwalds Klassiker der exakten Wissenschaften" Bd. 68, 1895 (Nachdruck 1990)
- Agafošin N. P. Periodičeskiй zakon i periodičeskaя sistema эlementov D. I. Mendeleeva. — M.: Prosveщenie, 1973. — 208 s.
- Evdokimov Ю., kandidat himič. nauk. K istorii periodičeskogo zakona. Nauka i žiznь, № 5 (2009), S. 12-15.
- Makarenя A. A., Rыsev Ю. V. D. I. Mendeleev. — M.: Prosveщenie, 1983. — 128 s.
- Makarenя A. A., Trifonov D. N. Periodičeskiй zakon D. I. Mendeleeva. — M.: Prosveщenie, 1969. — 160 s.
- Nekrasov B.V. (1973). Osnovы obщeй himii. 1. M.: Himiя. str. 656.
- Remi G. (1963). Kurs neorganičeskoй himii. 1. M.: Izd-vo inostrannoй lit-rы. str. 920.
Vanjske veze uredi
- Veliki periodni sustav elemenata (s objašnjenjima)
- Periodni sustav elemenata sa Kemijskog-Tehnološkog fakulteta - Split Arhivirano 2004-08-02 na Wayback Machine-u
- M. Dayah. „Dynamic Periodic Table”. Pristupljeno 14 May 2012.
- Brady Haran. „The Periodic Table of Videos”. University of Nottingham. Pristupljeno 14 May 2012.
- Mark Winter. „WebElements: the periodic table on the web”. University of Sheffield. Pristupljeno 14 May 2012.
- Mark R. Leach. „The INTERNET Database of Periodic Tables”. Pristupljeno 14 May 2012.