Cikloheksan
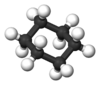
Cikloheksan je cikloalkan sa molekulskom formulom C6H12. Cikloheksan se koristi kao nepolarni rastvarač u hemijskoj industriji, i kao sirovina u industrijskoj produkciji adipinske kiseline i kaprolaktama, koji su intermedijari u proizvodnji najlona. Cikloheksan se industrijski proizvodi reakcijom benzena sa vodonikom. Zbog njegovih jedinstvenih hemijskih i konformacionih svojstava, cikloheksen takođe nalazi primeni u laboratorijskoj analizi i kao standard. Cikloheksen ima prepoznatljiv deterdžentu sličan miris.[6][7]
| Cikloheksan | |||
|---|---|---|---|
 |
 | ||
 | |||
| Identifikacija | |||
| CAS registarski broj | 110-82-7 | ||
| PubChem[1][2] | 8078 | ||
| ChemSpider[3] | 7787 | ||
| UNII | 48K5MKG32S | ||
| DrugBank | DB03561 | ||
| KEGG[4] | |||
| ChEBI | 29005 | ||
| ChEMBL[5] | CHEMBL15980 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C6H12 | ||
| Molarna masa | 84,16 g/mol | ||
| Gustina | 0,779 g/mL, tečnost | ||
| Tačka topljenja |
6.47 °C, 280 K, 44 °F | ||
| Tačka ključanja |
80.74 °C, 354 K, 177 °F | ||
| Rastvorljivost u vodi | Ne meša se | ||
| Indeks prelamanja (nD) | 1,4262 | ||
| Viskoznost | 1,02 cP na 17 °C | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
-156 kJ/mol | ||
| Std entalpija sagorevanja ΔcH |
-3920 kJ/mol | ||
| Opasnost | |||
| EU-klasifikacija | Zapaljiv (F) štetan (Xn) Opasan za okolinu (N) Jak iritant očiju | ||
| NFPA 704 | |||
| R-oznake | R11, R38, R65, R67, R50/53 | ||
| S-oznake | S2, S9, S16, S25, S33, S60, S61, S62 | ||
| Tačka paljenja | -20 °C | ||
| Srodna jedinjenja | |||
| Srodna cikloalkanske materije | Ciklopentan Cikloheptan | ||
| Srodna jedinjenja | Cikloheksen Benzen | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Istorija uredi
Za razliku od jedinjenja poput benzena, cikloheksan se ne može lako dobiti iz prirodnih izvora kao što je ugalj. Pri kraju devetnaestog veka rani hemijski istraživači su morali da razviju metode za sintezu.[8] Marcelin Bertelot je 1867. redukovao benzen jodovodoničnom kiselinom na povišenoj temperaturi. On je pogrešno identifikovao reakcioni proizvod kao n-heksan ne samo zato što ima istu tačku ključanja (69 °C), nego i zato što nije verovao da je benzen cikličan molekul. Jedan od njegovih skeptika, Adolf von Bajer, je 1870. ponovio reakciju i nazvao reakcioni proizvod heksahidrobenzen.
Bajer je 1894. sintetisao cikloheksan polazeći od Dikmanove kondenzacije pimelinske kiseline, što je bilo praćeno višestrukim redukcijama:
i iste godine su E. Havort i W.H. Perkin Jr. formirali isti proizvod koristeći Vurcovu reakciju počevši od 1,6-dibromoheksana.
Iznenađujuće je bilo da su njihovi cikloheksani ključali na temperaturi za 10 °C višoj od od heksahidrobenzena ili heksanaftena. Tu zagonetku su rešili Markovnikov, N.M. Kišner i Nikolaj Zelinski 1895, kad su utvrdili da se radi o metilciklopentanu, usled neočekivane reakcije preuređenja.
Danas se sinteza cikloheksana za iz benzena izvodi primenom naprednijih metoda redukcionih hemijskih reakcija.[9]
Vidi još uredi
Reference uredi
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ↑ Warnhoff, E. W. (1996). „The Curiously Intertwined Histories of Benzene and Cyclohexane”. Journal of Chemical Education 73 (6): 494. DOI:10.1021/ed073p494.
- ↑ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng. On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day. Lunds Tekniska Högskola 2008

