Benzen
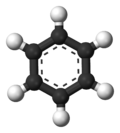
Benzen (trivijalni naziv: benzol), molekulske formule C6H6, je najjednostavniji aromatični ugljovodonik. Otkrio ga je Majkl Faradej 1825. godine tako što je izolovao benzen iz kitovog ulja i dobio bezbojnu tečnost karakterističnog mirisa. Tada je bila poznata samo molekulska formula.Osnovno jedinjenje velike grupe organskih aromatičnih jedinjenja - arena. Njegova gustina 0,885 g/cm³, tačka topljenja 5,5 °C, tačka ključanja 80,2°S. Gori svetlim i jako čađavim plamenom. Otrovan je i kancerogen i u tečnom i u gasovitom stanju. Dobija se pri suvoj destilaciji uglja u koksarima, na području nekadašnje Jugoslavije u Lukavcu i Zenici. Znatne količine se proizvode i sintetički, katalitičkim krekovanjem alifatičnih i naftenskih ugljovodonika. U svetu je 1975. godine proizvedeno 8,92 miliona tona. Upotrebljava se u hemijskoj industriji kao rastvarač, sredstvo za ekstrakciju i kao sirovina za druge proizvode.
| Benzene | |||
|---|---|---|---|
 |
 | ||
 |
 | ||

| |||
| IUPAC ime |
| ||
| Naziv po klasifikaciji | cikloheksa-1,3,5-trien | ||
| Drugi nazivi |
| ||
| Identifikacija | |||
| CAS registarski broj | 71-43-2 | ||
| PubChem[1][2] | 241 | ||
| ChemSpider[3] | 236 | ||
| UNII | J64922108F | ||
| EINECS broj | |||
| KEGG[4] | |||
| ChEBI | 16716 | ||
| ChEMBL[5] | CHEMBL277500 | ||
| RTECS registarski broj toksičnosti | CY1400000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C6H6 | ||
| Molarna masa | 78.11 g mol−1 | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Miris | aromatičan, sličan benzinu | ||
| Gustina | 0,8765(20) g/cm3[6] | ||
| Tačka topljenja |
5,5 °C, 278,7 K, 41,9 °F | ||
| Tačka ključanja |
80,1 °C, 353,3 K, 176,18 °F | ||
| Rastvorljivost u vodi | 1,79 g/L (15 °C)[7][8][9] | ||
| Rastvorljivost | rastvoran u alkoholu, hloroformu, CCl4, dietil etru, acetonu | ||
| log P | 2,13 | ||
| Napon pare | 10 kPa | ||
| λmax | 255 nm | ||
| Magnetna osetljivost | 54,8 x 10−6 cm3/mol | ||
| Indeks prelamanja (nD) | 1,50108 | ||
| Viskoznost | 0,652 cP na 20 °C | ||
| Dipolni moment | 0 D | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
48,7 kJ/mol | ||
| Standardna molarna entropija S |
173,26 J/K mol | ||
| Specifični toplotni kapacitet, C | 136,0 J/K mol | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | HMDB | ||
| EU-klasifikacija |
| ||
| NFPA 704 | |||
| R-oznake | R45, R46, R11, R16, R36/38,R48/23/24/25, R65 | ||
| S-oznake | S53, S45 | ||
| Tačka paljenja | −11,63 °C, 262 K | ||
| Tačka spontanog paljenja | 497,78 °C | ||
| Eksplozivni limiti | 1,2–7,8% | ||
| LD50 | 930 mg/kg (pacov, oralno) | ||
| Srodna jedinjenja | |||
| Srodna jedinjenja | |||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Benzenov prsten uredi
Benzenov prsten je šestočlani prsten koji obrazuju atomi ugljenika u strukturi molekula ugljovodonika benzola. Osnovni je strukturni sastojak organskih aromatičnih jedinjenja. Slobodni elektronski parovi ugljenika u prstenu su delokalizovani i iznad i ispod ravni prstena grade delokalizovane elektronske oblake. Ovakva struktura je hemijski veoma postojana pa su jedinjenja koja poseduju benzenov prsten, i pored postojanja nezasićenih veza, pretežno dezaktivirana za reakciju adicije. Prsten je pak podložan elektrofilnom napadu odnosno elektrofilnoj aromatičnoj supstituciji pri kojoj se očuvava aromatičnost (posebna pažnja se obraća na redosled uvođenja supstituenata zbog njihovih direkcionih uticaja). Dobijeni derivati imaju široku primenu.
Reference uredi
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). „Solubility of Benzene in Water”. Industrial & Engineering Chemistry Chemical & Engineering Data Series 3 (2): 253. DOI:10.1021/i460004a016.
- ↑ Breslow, R.; Guo, T. (1990). „Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers”. Proceedings of the National Academy of Sciences of the United States of America 87 (1): 167-9. Bibcode 1990PNAS...87..167B. DOI:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ↑ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. str. 114. ISBN 0-7506-7766-X. Pristupljeno 31. 5. 2012.
Literatura uredi
- Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. str. 114. ISBN 0-7506-7766-X. Pristupljeno 31. 5. 2012.
- Archibald Scott Couper, On a New Chemical Theory, Philosophical Magazine 16, 104-116 (1858)
- Josef Loschmidt, Chemische Studien I, Carl Gerold's Sohn, Vienna (1861),
- Josef Loschmidt, Chemische Studien I, Aldrich Chemical Co, Milwaukee (1989), catalog no. Z-18576-0, and (1913) catalog no. Z-18577-9
- Kathleen Lonsdale, "The Structure of the Benzene Ring in Hexamethylbenzene," Proceedings of the Royal Society 123A: 494 (1929).
- Kathleen Lonsdale, "An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method," Proceedings of the Royal Society of London, Vol. 133, No. 822, Oct. 1, 1931
Vanjske veze uredi
- ATSDR - Case Studies in Environmental Medicine: Benzene Toxicity
- Benzene Arhivirano 2007-02-02 na Wayback Machine-u
- Benzene Material Safety Data Sheet
- International Chemical Safety Card 0015
- National Pollutant Inventory - Benzene
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Benzene" Arhivirano 2005-10-12 na Wayback Machine-u
- Computational Chemistry Wiki Arhivirano 2006-10-02 na Wayback Machine-u
- Couper and Carbon bonds
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogenesis Studies of Benzene
- Kekule, Couper and dreams of Benzene
- Loschmidt's Benzene structure Arhivirano 2009-01-02 na Wayback Machine-u
- video podcast (Sir john Cadogan giving a lecture on Benzene since Faraday, in 1991)
- benzene 3D view and pdb-file
