Fluorovodonik
Fluorovodonik ili hidrogen fluorid (HF) je spoj u kojem fluor ima oksidacijsko stanje -1.
| Fluorovodonik | |||
|---|---|---|---|
 |
 | ||
| Identifikacija | |||
| CAS registarski broj | 7664-39-3 | ||
| PubChem[1][2] | 16211014 | ||
| ChemSpider[3] | 14214 | ||
| UNII | RGL5YE86CZ | ||
| KEGG[4] | |||
| ChEBI | 29228 | ||
| RTECS registarski broj toksičnosti | MW7875000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
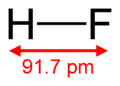
| Molekulska formula | HF | ||
| Molarna masa | 20.01 g mol−1 | ||
| Agregatno stanje | bezbojni gas | ||
| Gustina | 1.15 g/L, gas (25 °C) 0.99 g/mL, tečnost (19.5 °C) | ||
| Tačka topljenja |
-83.6 °C, 190 K, -118 °F | ||
| Tačka ključanja |
19.5 °C, 293 K, 67 °F | ||
| Rastvorljivost u vodi | meša se | ||
| pKa | 3.2 | ||
| Indeks prelamanja (nD) | 1.00001 | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Linearna | ||
| Dipolni moment | 1.86 D | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
−13.66 kJ/g (gas) −14.99 kJ/g (tečnost) | ||
| Standardna molarna entropija S |
8.687 J/g K (gas) | ||
| Opasnost | |||
| NFPA 704 | |||
| Srodna jedinjenja | |||
| Drugi anjoni | Hlorovodonik Bromovodonik Jodovodonik | ||
| Drugi katjoni | Natrijum fluorid | ||
| Srodna jedinjenja | Fluorovodonična kiselina | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Dobijanje
urediDobiva se reakcijom između kalcijum fluorida i sulfatne kiseline:
- CaF2 (s) + H+ + HSO4- → CaSO4 (s) + 2 HF (g)
Bezvodni HF se dobija po reakciji:
- NaHF2 (s) → NaF (s) + HF (g)
Osobine
urediZbog prisustva vodikove veze, fluorovodonik je tečnost, čija je tačka ključanja +20 °C. Miješa se s vodom i komercijalno dolazi kao 40%-tni rastvor. Vodeni rastvor fluorovodonika se naziva fluorovodonična kiselina. Ako rastvor dospije na kožu, uzrokuje gnojne rane. Bezvodni HF nije hemijski reaktivan, ali u prisustvu tragova vode reaguje s metalima i njihovim oksidima. Fluorovodonik reaguje sa silicijum dioksidom, pri čemu se oslobađa gasoviti SiF4. Kako je silicijum dioksid glavna komponenta stakla, HF se ne smije držati u staklenom posuđu.
- SiO2 (s) + 4 HF → SiF4 (g) + 2 H2O
Reference
uredi- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
