Baterija
Baterija je elektrohemijski uređaj u kome je uskladištena hemijska energija (u vidu potencijalne energije), koja se može pretvoriti u električnu energiju kada se krajevi baterije, elektrode, spoje provodnikom. Baterija je uređaj koji se sastoji od jedne ili više elektrohemijskih ćelija sa spoljnim priključcima za napajanje električnih uređaja kao što su baterijske lampe, pametni telefoni i električna kola.[1]
 Električne baterije raznih veličina i snaga | |
| Tip komponente | Napajanje |
|---|---|
| Princip rada | Elektrokemijska reakcija, elektromotorna sila |
| Izumitelj | Alessandro Volta |
| Prva proizvodnja | 1800. |
| Pinovi | plus i minus |
| Elektronski simbol | |
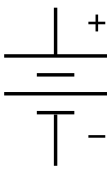 | |
Istorijski termin „baterija” se specifično odnosio na uređaj koji se sastojao od višestrukih ćelija, međutim njegova upotreba je evoluirala tako da sada obuhvata uređaje koji se sastoje od jedne ćelije.[2] Prva poznata baterija je Bagdadska baterija iz perioda 250. p. n. e. i 640. p. n. e. Moderne baterije rade na principu koji je izumeo italijanski fizičar Alesandro Volta 1800. godine.
Baterije spadaju u takozvane primarne izvore električne energije, jer pretvaraju hemijsku energiju u električnu i ne mogu se puniti (proces nije reverzibilan). Za razliku od baterija, akumulator spada u sekundarne elektrohemijske izvore (reverzibilne) električne energije i može više puta pretvarati hemijsku u električnu energiju i obrnuto (može se puniti i prazniti).
Baterije su dostupne u mnoštvu oblika i veličina, od minijaturnih ćelija koje se koriste za napajanje slušnih aparata i ručnih satova do malih, tankih ćelija koje se koriste u pametnim telefonima, do velikih olovno kiselinskih baterija ili litijum-jonskih baterija u vozilima, i u krajnjem ekstremu, ogromne baterijske banke veličine sobe koja pruža rezervnu ili hitnu snagu za telefonske centrale i računarske data centre. Prema proceni iz 2005. godine, industrija baterija je širom sveta generisala 48 američkih dolara milijardi u prodaji svake godine,[3] sa godišnjim rastom od 6%.
Istorija uredi
Upotreba „baterije” za opisivanje grupe električnih uređaja datira iz vremena Bendžamina Frenklina, koji je 1748. godine opisao višestruke Lejdenske posude po analogiji sa baterijom topova[4] (Bendžamin Frenklin je pozajmio termin „baterija” iz vojske, gde se odnosi na oružje koje zajednički dejstvuje[5]).
Italijanski fizičar Alesandro Volta izradio je i opisao prvu elektrohemijsku bateriju, voltni element, 1800. godine.[6] Ona se sastojala od bakarne šičke i cinkane ploče, razdvojenih rasolom natopljenim papirnim diskovima. Ona je mogla da proizvodi postojanu struju tokom znatnog vremenskog perioda. Volta nije razumeo da je napon posledica hemijskih reakcija. On je smatrao da su njegove ćelije neiscrpan izvor energije,[7] i da su povezani korozioni efekti na elektrodama puka neprijatnost, a ne neizbežna posledica njihovog rada, kao što je to pokazao Majkl Faradej 1834. godine.[8]
Rane baterije su bile od velike važnosti u eksperimentalnoj primeni, međutim u praksi su njihovi naponi fluktuirali i one nisu mogle da obezbede veliku struju tokom dužih perioda. Danijelovu ćeliju je izmeo 1836. godine britanski hemičar Džon Frederik Danijel. Ona je bila prvi praktični izvor elektirciteta, tako da je postala industrijski standard i doživela široku adaptaciju kao izvor napajanja za mreže električnih telegrafa.[9] Ona se sastojala od bakarne posude napunjene bakar sulfatnim rastvorom, u koji je bio uronjen neglazirani glineni sud napunjen sumpornom kiselinom sa cinkanom elektrodom.[10]
Ove vlažne ćelije su koristile tečne elektrolite, te su bile sklone curenju i prosipanju, ako se njima nije pravilno rukovalo. Mnoge su koristile staklene posude za držanje njihovih komponenti, što ih je činilo krhkim i potencijalno opasnim. Ove karakteristike su učinile vlažne čelije nepodobnim za portabilne vidove primene. Pri kraju devetnaestog veka, izum baterija sa suvim ćelijama, u kojima su tečni elektroliti zamenjeni pastom, učinio je praktičnim portabilne električne uređaje.[11]
Galvanski elementi uredi
Drugi naziv za bateriju je primarni galvanski element. Galvanski elementi su primarni hemijski izvori struje. Postoji više vrsta galvanskih elemenata: Voltin, Danijelov, Leklanšov itd.
Danijelov element uredi
Danijelovim elementom može se na jednostavan način objasniti princip baterije. Danijelov element se sastoji od cinkane elektrode potopljene u rastvor cink-sulfata (ZnSO4) i bakarne elektrode koja se nalazi u rastvoru bakar-sulfata (CuSO4), jedni od drugog odvojeni su posudom od poroznog materijala kroz čije zidove mogu da prolaze samo joni SO4. Kada se cinkana elektroda stavi u razblaženi vodeni rastvor cink-sulfata atomi cinka spontano prelaze u rastvor kao pozitivni joni Zn2+ ostavljajući svoja dva elektrona na elektrodi. Prelaženjem jona cinka u rastvor, elektroda postaje negativno naelektrisana, a rastvor pozitivno. U vrlo tankom pograničnom sloju između cinkane elektrode i rastvora nastaje električno polje usmereno tako da se suprotstavlja prelaženju jona Zn2+ u rastvor. Što više jona pređe u rastvor, ovo polje je sve jače. Ubrzo to električno polje dostiže onu vrednost pri kojoj se električna sila izjednačava sa hemijskom, te se dalje prelaženje jona Zn2+ u rastvor zaustavlja i naelektrisanje elektrode i rastvora se više ne povećavaju.
Leklanšov članak uredi
Postoje razni uređaji koji imaju sposobnost da na jednom (negativnom) priključku nagomilaju slobodne elektrone, koji zato nedostaju na drugom kraju uređaja ili pozitivnom priključku. Takav učinak može se postići na primer fizičko-hemijskim reakcijama u tzv. Leklanšovom članku, koji je bolje poznat pod izrazom baterijski članak ili baterija.[12][13][14] Leklanšov članak je vrsta galvanskog članka koji je dobio ime po francuskom električaru Žoržu Leklanšu. Ona se sastoji od suda od cinka u koji se smješta hemijski aktivna materija - tzv. elektrolit i u njemu uronjen ugljena šipka. Takav članak zahvaljujući fizičko-hemijskim procesima u elektrolitu stvara razliku potencijala od 1,5 V na svojim izvodima. Pri tome će se elektroni gomilati na cinkanom sudu, tj. cinkani plašt prikuplja negativni izvod, a ugljena šipka pozitivni izvod ili pol baterije.
Princip rada uredi
Kad baterija pruža električnu snagu, njen pozitivni priključak je katoda, a njen negativni priključak je anoda.[15] Terminal označen kao negativan je izvor elektrona koji će teći kroz spoljašnje električno kolo do pozitivnog terminala. Kad se baterija poveže na spoljašnje električno opterećenje, redoks reakcija konvertuje visoko-energetske reaktante u proizvode niske energije, i razlika slobodne energije se isporučuje spoljašnjem kolu kao električna energija.[16]
Negativni pol (anoda) je cinkana čašica. Pozitivni pol (katoda) je ugljeni štapić u smesi mangan-dioksida (MnO2) i ugljene prašine (čađi). Elektrolit je vodeni rastvor amonijum hlorida (NH4Cl(aq)) i cink hlorida (ZnCl2) koji je dodavanjem skroba pretvoren u pastu.
Zatvaranjem strujnog kola između negativnog i pozitivnog pola (iskorištavanja „baterije”), počinju reakcije:
- anodna reakcija na negativnom polu (čašici):
- Zn → Zn2+ + 2e-
- katodna reakcija na pozitivnom polu (štapiću):
- 2MnO2 + 2e- + 2NH4+ → Mn2O3 + 2NH3 + H2O
Zbrajanjem te dve reakcije se dobija:
- Zn + 2MnO2 + 2NH4+ → Zn2+ + Mn2O3 + 2NH3 + H2O
Dakle, na negativnom se polu oslobađaju dva elektrona koja putuju kroz potrošač (gde obavljaju određeni rad) te dolaze do pozitivnog pola, gde učestvuju u hemijskoj reakciji. Kad se sav cink na čašici „potroši” (odnosno kad većina cinka otpusti po dva elektrona), hemijska reakcija više nije moguća pa se kaže da je „baterija prazna”. Leklanšov članak nije ponovo punjiv, odnosno nakon „potrošnje” cinka postaje neupotrebljiv. Pokušaj punjenja baterija koje nisu za to predviđene, redovno rezultira eksplodiranjem, ili u najmanju ruku „naduvavanjem” baterije s curenjem agresivog elektrolita koji nagriza uređaje u koje je baterija uložena.
Novi Leklanšov članak (cink-ugalj) daje napon od 1,5 V. Neke vrste baterija (litijumske, nikal-kadmijumske i dr.) mogu međutim imati i manji radni napon, tj. 1,2 V po članku. Za veće napone, kombinuje se (povezuje se u seriju) više članaka. Baterije imaju mali kapacitet, pa se koriste za uređaje s malom potrošnjom struje. Za veću potrošnju koriste se akumulatori ili ispravljači, koji priključeni na gradsku električnu mrežu, postaju jednosmerni izvor. Ispravljači se često ugrađuju u uređaj koji napajaju.
Komponente uredi
Ćelije u bateriji mogu biti povezane paralelno, serijski ili kombinovano. Paralelna veza predstavlja vezu istoimenih elektroda i daje isti napon kao jedna ćelija, ali jaču struju zbog smanjene unutrašnje otpornosti izvora. Serijska veza predstavlja vezu gde se katoda jedne vezuje na anodu druge ćelije što na kraju daje istu struju kao jedna ćelija ali veći napon. Najveći broj baterija koje se koriste u praksi ima serijsku vezu.
Vrste uredi
Baterije se razvrstavaju na osnovu hemikalija koje sadrže, od čega zavisi da li su punjive ili je za jednokratnu upotrebu. U najčešće korišćenim tipovima baterija koriste se sledeće hemikalije: [17]
- Cink-ugljenična baterija: spada u najnekvalitetnije baterije za jednokratnu upotrebu. Iako jeftine, kratko traju pa se moraju često menjati.
- Alkalna baterija: traju oko triput duže od cink-ugljeničnih baterija.
- Nikal-kadmijeva baterija (Ni-Cd): najpopularniji tip punjivih baterija. Iako su mnogi proizvođači več rešili taj problem, najveći nedostatak nikl-kadmijumskih baterija je takozvani memorijski efekat, što znači da ih morate potpuno isprazniti pre ponovnog punjenja kako bi dostigle pun kapacitet.
- Nikal-metal-hidridna baterija (Ni-MH): vrlo raširen tip punjivih baterija za mobilne telefone. Odlikuje ih veći kapacitet i nemaju memorijski efekat kao nikl-kadmijumske.
- Litijumska baterija: veoma su lagane, generišu veći napon od baterija ostalih tipova. Litijumske baterije imaju i veći kapacitet od alkalnih. Skuplje su od ostalih i uglavnom nisu punjive. Međutim, za uređaje gde se mora voditi računa o težini, one su izuzetno prikladne. Dele se na litijum-polimerske i litijum-jonske baterije, koje se razlikuju po karakteristikama.
Upozorenje uredi
Na komercijalnim baterijama najčešće piše da se ne mogu (ne smeju) puniti, jer može doći do njihovog preteranog zagrevanja, pa čak i eksplozije. Pošto se u baterijama nalaze hemijska jedinjenja opasna po ljudski organizam i životnu sredinu potrebno je obratiti pažnju pri rukovanju sa njima.
- Treba voditi računa da naročito mala deca ne dođu u kontakt sa baterijama, jer je opasno da ih progutaju (može doći do trovanja).
- Posle upotrebe (prazne) baterije ne treba bacati na smetlište ili u prirodu već ih treba prikupljati i reciklirati, kako se ne bi zagađivala voda i zemljište (životna sredina).
Literatura uredi
- Pistoia, Gianfranco (2005). Batteries for Portable Devices. Elsevier. str. 1. ISBN 978-0-08-045556-3. Pristupljeno 18. 3. 2016.
- Pauling, Linus (1988). „15: Oxidation-Reduction Reactions; Electrolysis.”. General Chemistry. New York: Dover Publications, Inc.. str. 539. ISBN 978-0-486-65622-9.
- Crompton, T.R. (2000). Battery Reference Book (third izd.). Newnes. str. Glossary 3. ISBN 978-0-08-049995-6. Pristupljeno 18. 3. 2016.
- Dingrando, Laurel (2007). Chemistry: Matter and Change. New York: Glencoe/McGraw-Hill. ISBN 978-0-07-877237-5. Ch. 21 (pp. 662–695) is on electrochemistry.
- Fink, Donald G.; Beaty, H. Wayne (1978). Standard Handbook for Electrical Engineers, Eleventh Edition. New York: McGraw-Hill. ISBN 978-0-07-020974-9.
- Knight, Randall D. (2004). Physics for Scientists and Engineers: A Strategic Approach. San Francisco: Pearson Education. ISBN 978-0-8053-8960-9. Chs. 28–31 (pp. 879–995) contain information on electric potential.
- Linden, David; Reddy, Thomas B. (2001). Handbook of Batteries. New York: McGraw-Hill. ISBN 978-0-07-135978-8.
- Saslow, Wayne M. (2002). Electricity, Magnetism, and Light. Toronto: Thomson Learning. ISBN 978-0-12-619455-5. Chs. 8–9 (pp. 336–418) have more information on batteries.
Reference uredi
- ↑ Crompton, T.R. (2000). Battery Reference Book (third izd.). Newnes. str. Glossary 3. ISBN 978-0-08-049995-6. Pristupljeno 18. 3. 2016.
- ↑ Pistoia, Gianfranco (2005). Batteries for Portable Devices. Elsevier. str. 1. ISBN 978-0-08-045556-3. Pristupljeno 18. 3. 2016.
- ↑ Power Shift: DFJ on the lookout for more power source investments Arhivirano 1 December 2005[nepoklapanje datuma] na Wayback Machine-u.Draper Fisher Jurvetson. Pristupljeno 20 November 2005.
- ↑ Bellis, Mary. History of the Electric Battery[mrtav link]. About.com. Pristupljeno 11 August 2008.
- ↑ Society, National Geographic. „Quiz: What You Don't Know About Batteries”. National Geographic.
- ↑ Bellis, Mary. Biography of Alessandro Volta – Stored Electricity and the First Battery Arhivirano 2020-02-18 na Wayback Machine-u. About.com. Pristupljeno 7 August 2008.
- ↑ Stinner, Arthur. Alessandro Volta and Luigi Galvani Arhivirano 10 September 2008[nepoklapanje datuma] na Wayback Machine-u (PDF). Pristupljeno 11 August 2008.
- ↑ Electric Battery History – Invention of the Electric Battery Arhivirano 2019-02-22 na Wayback Machine-u. The Great Idea Finder. Pristupljeno 11 August 2008.
- ↑ Battery History, Technology, Applications and Development. MPower Solutions Ltd. Pristupljeno 19 March 2007.
- ↑ Borvon, Gérard (10. 9. 2012). „History of the electrical units”. Association S-EAU-S.
- ↑ „Columbia Dry Cell Battery”. National Historic Chemical Landmarks. American Chemical Society. Arhivirano iz originala na datum 23. 2. 2013. Pristupljeno 25. 3. 2013.
- ↑ Leclanché, "une pile à oxyde insoluble" [an insoluble oxide battery], French patent no. 71,865 (issued: 8 June 1866) in: French Ministry of Agriculture and Commerce (1881) (French). Description des machines et procédés pour lesquels des brevets d'invention ont été pris … [Descriptions of machines and procedures for which patents have been taken …]. vol. 98. Paris, France: Imprimerie Nationale. str. 33-34.
- ↑ Leclanché, Georges (1868). „Quelques observations sur l’emploi des piles électriques. Pile constante au peroxyde de manganèse à un seul liquide.”. Les mondes 16: 532.
- ↑ Jensen, William B. (januar 2014). „The Leclanché Cell. Museum Notes, Oesper Collections.”. Pristupljeno 26. 12. 2017.
- ↑ Pauling, Linus (1988). „15: Oxidation-Reduction Reactions; Electrolysis.”. General Chemistry. New York: Dover Publications, Inc.. str. 539. ISBN 978-0-486-65622-9.
- ↑ Schmidt-Rohr, Klaus (2018). „How Batteries Store and Release Energy: Explaining Basic Electrochemistry”. Journal of Chemical Education 95 (10): 1801-1810. Bibcode 2018JChEd..95.1801S. DOI:10.1021/acs.jchemed.8b00479.
- ↑ Gordon McComb i Earl Boysen, Elektronika za neupućene (str. 91), Beograd, 2007.