Aziridin
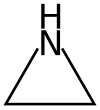
Aziridini su organska jedinjenja koja sadrže aziridinsku funkcionalnu grupu, tročlano heterociklično jedinjenje sa jednom amino grupom i dve metilenske grupe.[6][7] Osnovno jedinjenje je aziridin (ili etilen imin), sa molekulskom formulom C2H5N.
| Aziridin | |||
|---|---|---|---|
 |
 | ||
| IUPAC ime |
| ||
| Drugi nazivi | Azaciklopropan, Etilen imin | ||
| Identifikacija | |||
| CAS registarski broj | 151-56-4 | ||
| ChemSpider[1] | 8682 | ||
| EINECS broj | |||
| KEGG[2] | |||
| ChEMBL[3] | CHEMBL540990 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C2H5N | ||
| Molarna masa | 43.07 g mol−1 | ||
| Agregatno stanje | Clear colorless oily liquid[4] | ||
| Gustina | 0.8321 g/ml 20 °C[5] | ||
| Tačka topljenja |
-77.9 °C | ||
| Tačka ključanja |
56 °C | ||
| Rastvorljivost u vodi | miscible all proportions | ||
| Opasnost | |||
| Tačka paljenja | -11 °C | ||
| Srodna jedinjenja | |||
| Srodna heterociklizacija | Boriran, Etilen oksid, Etilen sulfid | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Struktura uredi
Uglovi veza aziridina su aproksimativno 60°, što je znatno manje od normalnog ugljovodoničnog ugla veze od 109.5°. Posledica toga je angularno naprzanje slično molekulima ciklopropana i oksirana. Model savijenih veza objašnjava vezivanje takvih jedinjenja. Aziridin je manje bazan nego aciklični alifatični amini, sa pKa od 7.9 za konjugovanu kiselinu, usled povećanog s karaktera slobodnog elektronskog para azota. Angularno naprezanje u aziridinu takođe povišava barijeru inverzije azota. Visina ove barijere omogućava izolaciju zasebnih invertomera, na primer cis i trans invertomeri N-hloro-2-metilaziridina.
Sinteza uredi
Postoji više sintetičkih puteva.
Ciklizacija haloamina i amino alkohola uredi
Aminska funkcionalna grupa istiskuje susedni halid u reakciji intramolekulske nukleofilne supstitucije čime se formira aziridin. Amino alkoholi imaju jednaku reaktivnost, ali se hidroksilna grupa mora prvo konvertovati u dobru odlazeću grupu. Ciklizacija amino alkohola se zove Venkerova sinteza (1935), a ciklizacija haloamina Gabrielov etileniminski metod (1888)[8].
Adicija nitrena uredi
Adicija nitrena u alkene je dobro-poznat metod za sintezu aziridina. Fotoliza ili termoliza azida su pouzdani načini formiranja nitrena. Nitreni takođe mogu da se pripreme in situ iz jodozobenzen diacetata i sulfonamida, ili etoksikarbonilnitren iz N-sulfoniloksi precursora.[9]
Reference uredi
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ „Aziridine” (pdf).
- ↑ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑ Heterocyclic chemistry. Harlow, England: Longman Scientific. 1987. ISBN 978-0-582-01421-3.
- ↑ Albert Padwaa and S. Shaun Murphreeb (2006). „Epoxides and aziridines - A mini review”. Arkivoc: 6-33.
- ↑ „Gabriel Ethylenimine Method”.
- ↑ Addition reactions of ethoxycarbonylnitrene and ethoxycarbonylnitrenium ion to allylic ethers M. Antonietta Loreto, Lucio Pellacani, Paolo A. Tardella, and Elena Toniato Tetrahedron Letters, Volume 25, Issue 38, 1984, Pages 4271-4274 Abstract
Literatura uredi
- Heterocyclic chemistry. Harlow, England: Longman Scientific. 1987. ISBN 978-0-582-01421-3.