CRAL-TRIO domen
CRAL-TRIO domen je proteinski strukturni domen koji vezuje male lipofilne molekule.[2] Taj domen je dobio ime po ćelijskom proteinu koji vezuje retinaldehid (CRALBP) i TRIO faktoru razmene guanina.
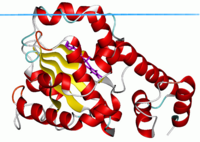
| |||||||||
| Alfa-tokoferolni transfer protein u zatvorenom stanju sa ligandom.[1] | |||||||||
| Identifikatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Simbol | CRAL_TRIO | ||||||||
| Pfam | PF00650 | ||||||||
| InterPro | IPR001251 | ||||||||
| SMART | Sec14 | ||||||||
| SCOP | 1aua | ||||||||
| Superfamilija | 1aua | ||||||||
| OPM protein | 129 | ||||||||
| OPM protein | 1r5l | ||||||||
| |||||||||
CRALB protein nosi 11-cis-retinol ili 11-cis-retinaldehid. On posreduje interakciju retinoida sa enzimima vizuelnog ciklusa. TRIO učestvuje u koordinaciji aktinskog remodelovanja, koje je neophodno za ćelijsku migraciju i rast.
Drugi članovi familije su alfa-tokoferolni transfer protein i fosfatidilinozitol-transfer protein (Sec14). Oni transportuju supstrate (alfa-tokoferol i fosfatidilinozitol ili fosfatidilholin, respektivno) između raznih intraćelijskih membrana. Familija takođe obuhvata guanin nukleotidni faktor razmene koji može da funkcioniše kao efektor RAC1 malog G-proteina.
N-terminalni domen kvaščanog ECM25 proteina sadrži CRAL-TRIO domen.[3]
Struktura uredi
Sec14 protein je bio prvi CRAL-TRIO domen čija struktura je određena.[4] Struktura sadrži nekoliko alfa heliksa kao i beta ravan koja se sastoji od 6 lanaca. Lanci 2, 3, 4 i 5 formiraju paralelnu beta ravan, dok su lanci 1 i 6 antiparalelni. Struktura takoše ima hidrofobno mesto vezivanja lipida.
Ljudski proteini koji sadrže ovaj domen uredi
C20orf121; MOSPD2; PTPN9; RLBP1; RLBP1L1; RLBP1L2; SEC14L1; SEC14L2; SEC14L3; SEC14L4; TTPA;
Reference uredi
- ↑ Min KC, Kovall RA, Hendrickson WA (December 2003). „Crystal structure of human alpha-tocopherol transfer protein bound to its ligand: implications for ataxia with vitamin E deficiency”. Proc. Natl. Acad. Sci. U.S.A. 100 (25): 14713–8. DOI:10.1073/pnas.2136684100. PMC 299775. PMID 14657365.
- ↑ Panagabko C, Morley S, Hernandez M, et al. (June 2003). „Ligand specificity in the CRAL-TRIO protein family”. Biochemistry 42 (21): 6467–74. DOI:10.1021/bi034086v. PMID 12767229.
- ↑ Gallego O, Betts MJ, Gvozdenovic-Jeremic J, et al. (November 2010). „A systematic screen for protein-lipid interactions in Saccharomyces cerevisiae”. Mol. Syst. Biol. 6 (1): 430. DOI:10.1038/msb.2010.87. PMC 3010107. PMID 21119626.
- ↑ Sha B, Phillips SE, Bankaitis VA, Luo M (January 1998). „Crystal structure of the Saccharomyces cerevisiae phosphatidylinositol-transfer protein”. Nature 391 (6666): 506–10. DOI:10.1038/35179. PMID 9461221.
Spoljašnje veze uredi
- UMich orijentacija proteina u membranama families/superfamily-129 - Calculated spatial positions of CRAL-TRIO domains in membrane