Citokineza
Citokineza (stgrč. κύτος - kytos = šupljina, latinska izvedenica cyto- = ćelijsko + κίνησις – kínesis = kretanje) je dio ćelijske diobe, procesa tokom kojeg citoplazma jedne eukariotske ćelije dijeli se u dvije ćelije kćeri. Podjela citoplazme odvija se tokom kasnih stadija podjele jedra u mitozi i mejozi. Tokom citokineze diobeni aparat, podjeli i transportira duplirane hromatide u citoplazmi razdvajajućih kćeri ćelija. To osigurava da broj hromosoma i hromosomski komplement održavaju stalnost iz jedne generacije u drugu i da, osim u posebnim slučajevima, kćeri ćelije budu funkcionalne kopije roditeljske ćelije. Nakon završetka telofaze i citokineze, svaka kći ćelija ulazi u interfazu ćelijskog ciklusa.[1]
Posebne funkcije zahtijevaju različite odstupanja od procesa simetrične citokineze; naprimjer, u oogenezi kod životinja jajašce uzima gotovo svu citoplazmu i organele. To ostavlja vrlo malo materijala za polarno tijelo, koje u većini vrsta ugiba bez funkcije, iako kod drugih vrsta ima razne specijalne funkcije.[2]
Drugi oblik mitoze javlja se u tkivima kao što su jetra i skeletni mišići; tu izostaje citokineza, čime nastaju multijedarne ćelije. Biljna citokineza razlikuje se od životinjske, dijelom zbog krutosti zidova biljnih ćelija. Umjesto da formiranjaju rascjepnu brazdu, kao što se razvija između životinjskih ćerki ćelija, u citoplazmi se razvija razdvajajuća struktura poznata kao ćelijska ploča i urasta u novi, dvostruki ćelijski zid između biljnih ćerki ćelija.
Citokineza u velikoj mjeri podsjeća na prokariotski proces binarne diobe, ali se, zbog razlika između prokariota i eukariota, ćelijske strukture, funkcije i mehanizmi međusobno razlikuju. Naprimjer, bakterijska ćelija ima samo jedan hromosom u obliku zatvorenog prstena, za razliku od linearnih, obično njih više, hromosoma kod eukariota. U skladu s tim, bakterijski konstrukt nema mitotsko vreteno u ćelijskoj diobi. Također, dupliranje prokariotske DNK odvija se tokom stvarnog razdvajanja hromosoma; mitotska duplikacija dešava se tokom interfaze, prije početka mitoze, iako se kćeri hromatide ne odvajajaju u potpunosti prije anafaze.
Citokineža životinjskih ćelija uredi
Citokineza životinjske ćelije počinje ubrzo nakon početka odvajanje sestrinskih hromatida u anafazi mitoze. Proces se može podijeliti na sljedeće različite korake:
- reorganizacija anafaznog vretena,
- specifikacije siobene ravni,
- formiranje i kontrakcija aktinsko-miozinskog prstena, i
- razdvajanje.[3] Vjerna podjela genoma u nastajućim ćerkama ćelijama je osigurana u uskoj vremenskoj koordinaciji pojedinačnih događaja putem molekularnih signalnih puteva.
Reorganizacija anafaznog diobenog vretena uredi
Citokineza životinjskih ćelija počinje stabiliziranjem mikrotubula i reorganizacijom mitotskog vretena za formiranje centralnog diobenog vretena. Centralno vreteno (srednja zona vretena) formira se kada se nekinetohorne mikrotubulske niti postavljene između polova vretena. Brojnim vrstam, kao što su Homo sapiens, Drosophila melanogaster i Caenorhabditis elegans, potrebna je centralne osovina kako bi se efikasno odvijala citokineza, iako specifični fenotip kada je i nema varira od jedne do druge vrste (naprimjer, određene vrste ćelija u rodu Drosophila nesposobne su za formiranje rascjepne brazde bez centralnog vretena, dok se u embrionu C. elegans i ćelijama ljudske kulture tkiva uočava se rascjepna brazda koja se formira i urasta, ali onda se smanjuje, prije kompletiranja citokineze).[4] Pad aktivnosti CDK1 tokom tranzicije metafaza-anafaza dovodi do defosforilacijke inhibicijskih lokacija na više komponenti centralne osovine. Prije svega, uklanjanje CDK1 fosforilacije u podjedinici ZKP (hromosomski transportni kompleks) omogućava njegovu translokalizaciju na centralnu osovinu iz centromere, gdje se nalazi u metafazi. Osim što je strukturna komponenta samog centralnog vretena, CPC također ima i ulogu u fosforegulaciji drugih komponenti centralne osovine, uključujući PRC1 (mikrotubulski vezivni protein potreban za citokineza 1) i MKLP1 (motorni protein kinezin). Prvobitno inhibirana fosforilacija CDK1 koja je posredovana putem PRC1 tada je u mogućnosti da formira homodimer koji se selektivno veže za poveznicu između antiparalelnih mikrotubula, olakšavajući prostornu organizaciju mikrotubula centralne osovine. MKLP1, zajedno sa Rho-porodicom GTPaza aktivira protein CYK-4 (također nazvan MgcRacGAP), koji čini centralni kompleks vretena, centralspindin. Centralspindlin veže se na centralnu osovinu kao klaster višeg reda. Promocija formiranja centralspindlinskog klastera odvija se fosforilacijom MLKP1, pomoću Aurore B, komponente CPC-a. Ukratko, samoorganizacija centralnog vretena pokreće se putem fosforegulacije više komponenti centralne osovine, zbog pada CDK1 aktivnosti, direktno ili indirektno, na prelazu metafaza-anafaza.
Centralno vreteno u citokinezi može imati višestruke funkcije, uključujući kontrolu pozicionoranja rascjepne brazde, otpuštanja membranskih vezikula na tu brazdu i formiranje strukture srednjeg tijela koja je potrebna za konačni korak podjele.[5]
Specifikacija diobene ploče uredi
Drugi korak u citokinezi životinjskih ćelija podrazumijeva podjelu diobene ravni i formiranje citokinetičke brazde. Precizno pozicioniranje diobene ploče između dvije mase razdvojenih kromosoma (hromatida) je od suštinskog značaja za sprečavanje gubitka hromosoma. Istovremeno, mehanizam kojim vreteno određuje diobenu ravan u životinjskim ćelijama možda je najtrajnija misterija u citokinezi i predmet intenzivne rasprave. Postoje tri hipoteze o indukciji brazda.[5] Prva hipoteza je o astrerskoj stimulaciji, koja pretpostavlja da astralne mikrotubule iz polova vretena prenose signal sa brazde na korteks ćelije, gdje se signali iz dva pola nekako fokusiraju u prsten na osovini. Druga mogućnost, zvana hipoteza o centralnom vretenu počiva na pretpostavci da je rascjepna brazda izazvana pozitivnim stimulansom koji potiče sa ekvatora centralnog vretena.
Centralno vreteno može doprinijeti specifikaciji diobene ravni promoviranjem koncentracije i aktiviranjem male GTPaze RhoA na ekvatorskom korteksu. Treća hipoteza odnosi se na astralno opuštanje. Ona predlaže da se da se aktivni aktin-miozin snopovi distribuiraju širom korteksa ćelije pa inhibicija njihove kontrakcije blizu polova vretena dovodi do pojave gradijenta kontraktilnih djelatnosti koja je najviša u središnjoj tački između polova. Drugim riječima, astralne mikrotubule generiraju negativni signal koji povećava korteksno opuštanje blizu polova. Genetičke i lasersko-mikromanipulacijske studije na embrionu C. elegans pokazale su da osovina šalje dva redundantna signala ćelijama korteksa, jedan porijeklom iz centralne osovine, a drugi proizilazi iz astera (na polu) vretena, što ukazuje na uključenost više kombiniranih mehanizama u pozicioniranje rascjepne brazde. Dominacija jednog posebnog signala varira između tipova ćelija i organizama. I mnoštvo parcijalnih redundantnih signala može biti potrebno za sačini robusni sistem i poveća prostornu preciznosti.[3]
Kontrakcija aktinsko-miozinskog prstena uredi
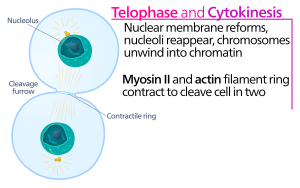
Na citokinetičkoj brazdi, postoji aktinsko-miozinski kontraktilni prsten koji pokreće proces rascjepa, tokom kojeg ćelijska membrana i zid rastu prema unutra, što na kraju „uštine“ (suzi) ćeliju majku u dva područja. Ključne komponente ovog prstena su vlaknasti proteini aktin i motorni protein miozin II. Kontraktilni prsten steže se ekvatorskog dijela (u sredini ćelije) na ćelijskom korteksu (uz ćelijsku membranu). Porodica Rho proteina (RhoA proteini u ćelijama sisara) ključna je u regulaciju formiranja kontraktilnog prstena i kontrakcija u životinjskim ćelijama.[5] RhoA put pokreće kompleks aktinsko-miozinskog prstena pomuću dva glavna efektora. Prci, RhoA stimulira nukleaciju niti aktina putrem aktivacije formina srodnih diafanu. Ovo lokalno generiranje novih aktinskih filamenata je značajno za formiranje kontraktilnog prstena.[5] Ovaj proces formiranja aktinskog filamenta također podrazumijeva uključenje proteina profilina, koji se veže za monomere aktina i pomaže im učitavanje na kraju niti. Drugo, RhoA promovira aktiviranje miozina II, putem kinaze ROCK, koja aktivira miozin II direktnom fosforilacijom lahkog lanca miozina i inhibira miozin-fosfatazu preko fosforilacije podjedinice MYPT, koja je cilj fosfataze. Osim aktina i miozinski (II), kontraktilni prsten sadrži skelu od proteina anilina. Anilin se veže za aktin, miozin, RhoA i CYK-4 i na taj način povezuje ekvatorijalni korteks sa signalima iz centralne osovine. Također doprinosi i povezanosti aktinsko-miozinskog prstena Sa plazma membranOM. Za drugi protein, septin, također se spekuliralo da služi kao strukturnA skelA na kojoj je organizovan citokinezni aparat. Nakon njegove montaže, kontrakcija aktinsko-miozinskog prstena vodi ka prodiranju veze sa plazma membranom, koja razdvaja citoplazmu u dva domena nastajanjućiH sestrinskiH ćelija. Snaga za procese nastanka kontrakcija potiče od pokreta niza aktinskih motornih proteina i miozina II. Miozin II koristi slobodnu energiju koja se otpušta kada ATP hidrolizira i kreće duž ovih aktinskih vlakna, stežući ćelijske membrane da se formira rascjepna brazda. Nastavak hidrolize uzrokuje pojavu ove brazde koja prodire (kretanjem prema unutra), što je upečatljiv proces koji je jasno vidljiv kroz svjetlosni mikroskop.
Razdvajanje uredi
Citokinetička brazda urasta do oblikovanja takozvanog strukture srednjeg tijela (sastavljene od proteinskog materijala sa gustim elektronima), gdje aktinsko-miozinski prsten doseže promjer od oko 1-2 um. Većina vrsta životinjskih ćelija ostaje povezana međućelijskim mostom i do nekoliko sati, dok se ne podijele u procesu koji je neovisan od aktina, zvanom razdvajanje, što je zadnji korak u citokinezi.[3] Proces apscizije (odsijecanja) fizički razdvaja pomenuto srednje tijelo u dva istovjetna. Odvija se uklanjanjem citoskeletnih struktura iz međućelijskog mosta, suženjem korteksa ćelije i razdvajanjem plazma membrane. Međućelijski most je ispunjen gustim snopovima antiparalelnih hmikrotubula koje potiču iz centralne osovine. Ove mikrotubule preklapaju se na srednjim tijelom, za koji se obično misli kao na ciljanu platformu mehanizma razdvajanja. Razdvajajući mikrotubulski protein je spastin, koji je u velikoj mjeri odgovoran za demontažu snopova mikrotubula unutar međućelijskih mostova. Kompletno kortikalno suženje također podrazumijeva uklanjanje osnovne citoskeletne strukture. Razlaganje aktinskih filamenta tokom kasne citokineze zavisi od PKCε-14-3-3 kompleksa, koji deaktivira RhoA, nakon prodiranja rascjepne brazde. Aktinski filamwenti rastavljaju se dalje pod kontrolom GTPaze Rab35 i njenih efektora, na oblik fosfatidilinozitol-4,5-bisfosfat 5-fosfataza OCRL. Razumijevanje mehanizma kojima se na kraju dijeli plazma membrana, još uvijek se dodatno istražuje.
Tok citokineze uredi
Citokineza mora biti vremenski kontrolirana, kako bi se osiguralo da se javlja tek nakon što se sestrinske hromatide odvoje tokom normalne proliferativne ćelijske diobe u anafazi. Da bi se to postiglo, mnoge komponente citokineze su visoko regulirane, a da bi se osigurala mogućnost obavljanja određene funkcije samo u određenoj fazi ćelijskog ciklusa.[6][7] Citokineza se događa tek nakon što se APC veže sa CDC20. To omogućava da odvajanje hromosoma i miozin djeluju istovremeno..
Nakon citokineza, mikrotubule bez kinetohora reorganizaciju se i nestaju u novom citoskeletu kako se ćelijski ciklus vraća u interfazu. (vidi i ćelijski ciklus).
Ctokineza biljnih ćelija uredi
Zbog prisustva ćelijskog zida, citokineza u biljnim ćelijama se znatno razlikuje od one u životinjskim ćelijama, jer umjesto formiranja kontraktilnog prstena, biljna ćelija gradi ćelijsku ploču u sredini ćelije. Faze formiranja ćelijske ploče uključuju:
- (1) stvaranje fragmoplasta, od niza mikrotubula koje vodi i podržava formiranje ćelijske ploče;
- (2) prijenos vezikula diobene ravni i njihovo spajanje za generiranje cjevasto-mehuraste mreže;
- (3) kontinuirano spajanje membranskih cijevi i njihovo pretvaranje u membrane nakon taloženja kaloza, a zatim taloženje celuloze i drugih komponenti ćelijskog zida;
- (4) recikliranje višaka membrane i drugih materijala iz ćelijske ploče; i
- (5) fuzija sa roditeljskim ćelijskim zidom.[8][9]
Fragmoplast je sastavljen od ostataka mitotskog vretena, koje služi kao traka za prenos vezikula do srednje zone fragmoplasta. Ove vezikule sadrže lipide, proteine i ugljikojhidrate koji su neophodni za formiranje novih ćelijskih granica. Elektronsko-tomografske studije identificirale su da je Golgijev aparat izvor tih vezikula.[10][11] but other studies have suggested that they contain endocytosed material as well.[12][13]
Ove cijevi proširuju se zatim i međusobno, bočno spajaju, na kraju formirajući planarni, fenestrirani list. Kako sazrijeva ćelijska ploča, otklanjaju se velike količine membranskog materiala putem endocitoje, koja je posredovana klatrinom. Eventualno, rubovi ćelijske ploče spajaju se sa roditeljskom plazma membranom, često asimetrično,[14] čime se završava citokineza. Preostali materijal sadrži niti endoplazmatske mreže koja prolazi kroz njih, a smatra se da su prekursori plazmodezmi.
Izgradnja novog ćelijskog zida počinje u lumenu uskih kanalića mlade ćelijske ploče. Redoslijed kojim sa ugrađuju različite komponente ćelijskog zida utvrđen je pomoću imuno-elektronske mikroskopije. Prvo dolaze pektini, hemiceluloza i arabinogalaktanski proteini koje donose sekrecijske vezikule koje se spajaju i formiraju čelijsku ploču.[15] Slijedeća komponenta koja se dodaje je kaloza, koja se polimerizira neposredno na ćelijskoj ploči pomoću kaloza-sintaze. Kako ćelijska ploča nastavlja da zrije i stapa se sa roditeljskom plazma membranom, kaloza polahko zamjenjuje se celulozom, primarnom komponentom zrelog ćelijskog zida. Srednja lamela (ljepljivi sloj koji sadrži pektin) razvija se iz ćelijske ploče, a služi za vezanje zida sa susjednom ćelijom.[16][17]
Snage u citokinezi životinjske ćelije uredi
Prodiranje citokinetičke brazde pokreće lučenje miozin-ATPaza tipa II. Dok miozini djeluju na medijalni region, kontraktilne sile koje djeluju na korteks liče na 'nanizane kesice' suženja, koje vuče brazdu prema unutra. To dovodi do unutrašnjeg sužavanja. Plazma membrana, zahvaljujući bliskoj povezanosti sa korteksm zatvara brazdu preko poprečnih proteinskih linkera.[18]
Povezano uredi
Reference uredi
- ↑ Sofradžija A., Šoljan D., Hadžiselimović R. (2007). Biologija 1.. Svjetlost, Sarajevo. ISBN 9958-10-686-8.
- ↑ Schmerler, Samuel. Wessel, Gary. Polar Bodies - more a lack of understanding than a lack of respect Mol Reprod Dev. 2011 January ; 78(1): 3–8. doi:10.1002/mrd.21266.
- ↑ 3,0 3,1 3,2 Fededa, Juan Pablo; Gerlich, Daniel W. (May 2012). „Molecular control of animal cell cytokinesis”. NATURE CELL BIOLOGY 14: 440–447.
- ↑ Fededa, Juan Pablo; Gerlich, Daniel W. (2012). „Molecular control of animal cell cytokinesis”. NATURE CELL BIOLOGY 14: 440–447.
- ↑ 5,0 5,1 5,2 5,3 Morgan, David (2007). The Cell Cycle. New Science Press. str. 157–173.
- ↑ Mishima J. (2004). „: "Cell cycle regulation of central spindle correctly”. Nature 430: 908–913.
- ↑ Petronczki (2007). „Polo-like kinase 1 triggers the initiation of cytokinesis in human cells by promoting recruitment of the RhoGEF Ect2 to the central spindle”. Developmental Cell 12: 713–725.
- ↑ Otegui M., Staehelin L.A. (2000). „Cytokinesis in flowering plants: more than one way to divide a cell”. Curr. Opin. Plant Biol. 3: 493–502.
- ↑ Samuels A.L.; Giddings T.H.Jr.; Staehelin L.A. (1995). „Cytokinesis in tobacco BY-2 and root tip cells: a new model of cell plate formation in higher plants”. J. Cell Biol. 130: 1345–1357.
- ↑ Otegui M.S.; Mastronarde D.N.; Kang B.H.; Bednarek S.Y.; Staehelin L.A. (2001). „Three-dimensional analysis of syncytial-type cell plates during endosperm cellularization visualized by high resolution electron tomography”. Plant Cell 13: 2033–2051.
- ↑ Segui-Simarro, J.M., Austin, J.R.,2nd, White, E.A., and Staehelin, L.A. "Electron tomographic analysis of somatic cell plate formation in meristematic cells of Arabidopsis preserved by high-pressure freezing." Plant Cell 2004; 16, 836-856
- ↑ Baluška F.; Liners F.; Hlavačka A.; Schlicht M.; Van Cutsem P.; McCurdy D.W.; Menzel D. (2005). „Cell wall pectins and xyloglucans are internalized into dividing root cells and accumulate within cell plates during cytokinesis”. Protoplasma 225: 141–55.
- ↑ Dhonukshe P.; Baluška F.; Schlicht M.; Hlavacka A.; Šamaj J.; Friml J., Jr (2006). „Endocytosis of cell surface material mediates cell plate formation during plant cytokinesis”. Dev. Cell 10: 137–50.
- ↑ Cutler S.R., Ehrhardt D.W. (2002). „Polarized cytokinesis in vacuolate cells of Arabidopsis”. Proc. Natl. Acad. Sci. USA 99: 2812–2817.
- ↑ Staehelin, L.A., and Moore, I. "The Plant Golgi Apparatus: Structure, Functional Organization and Trafficking Mechanisms." Annu. Rev. Plant Physiol. Plant Mol. Biol. 46, 261-288 (1995)
- ↑ Charles E. Allen (July 1901). „On the Origin and Nature of the Middle Lamella”. Botanical Gazette 32 (1): 1–34. DOI:10.1086/328131. JSTOR 2464904.
- ↑ Eichorn, Susan, et al. Esau's Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development, 3rd Edition. 2006. ISBN 978-0-471-73843-5
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002)."Cross-linking Proteins with Distinct Properties Organize Different Assemblies of Actin Filaments". Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1
Dopunska literatura uredi
- The Molecular Requirements for Cytokinesis by M. Glotzer (2005), Science 307, 1735
- "Animal Cytokinesis: from parts list to mechanism" by Eggert, U.S., Mitchison, T.J., Field, C.M. (2006), Annual Review of Cell Biology 75, 543-66
- Campbell Biology (2010), 580-582
- More description and nice images of cell division in plants, with a focus on fluorescence microscopy Arhivirano 2010-06-22 na Wayback Machine-u
- Nanninga N (June 2001). „Cytokinesis in Prokaryotes and Eukaryotes: Common Principles and Different Solutions”. Microbiol. Mol. Biol. Rev. 65: 319–33. DOI:10.1128/MMBR.65.2.319-333.2001. PMC 99029. PMID 11381104.