Balmerova serija
Balmerova serija u atomskoj fizici, prestavlja jednu od emisionih spektralnih linija vodika, koja nastaje skokom elektrona iz viših kvantnih energetskih razina u niže kvantne energetske razine. Balmerovu seriju se može izračunati sa Balmerovom formulom, a to je empirijska formula koju je otkrio Johann Balmer 1885. [1]


Vidljivi dio spektra vodika pokazuje četiri valne duljine: 410 nm, 434 nm, 486 nm i 656 nm, i prestavljaju emisiju fotona, koja nastaje skokom elektrona sa više energetske razine na energetsku razinu 2. Jedan dio Balmerove serije je u ultraljubičastom dijelu spektra, jer je valna duljina manja od 400 nm.
Pregled uredi
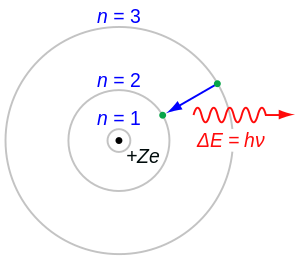
Balmerova serija prestavlja prijelaz elektrona sa n ≥ 3 na n = 2, gdje je n broj energetske razine. Prvi prijelaz sa 3=>2 prestavlja H-alfa, 4=>2 prestavlja H-beta, 5=>2 prestavlja H-gama, 6=>2 prestavlja H-delta itd.
| Prijelaz n | 3→2 | 4→2 | 5→2 | 6→2 | 7→2 | 8→2 | 9→2 | →2 |
|---|---|---|---|---|---|---|---|---|
| Naziv | H-α | H-β | H-γ | H-δ | H-ε | H-ζ | H-η | |
| Valna duljina (nm) [2] | 656,3 | 486,1 | 434,1 | 410,2 | 397,0 | 388,9 | 383,5 | 364,6 |
| Boja | Crvena | Cijan | Plava | Ljubičasta | (Ultraljubičasta) | (Ultraljubičasta) | (Ultraljubičasta) | (Ultraljubičasta) |
Balmerova jednadžba je pomogla stvaranju Rydbergove formulw, za cijeli spektar vodika, koja je omogućila pronalazak Lymanove serije, Paschenove serije i Brackettove serije, koje se nalaze izvan vidljivog dijela spektra.
Poznata crvena H-alfa spektralna linija plinovitog vodika, koja prestavlja prijalaz Balmerove serije sa energetske razine n = 3 na n = 2, je jedna od najupadljivijih boja u svemiru. Ona doprinosi emisionom spektru ionizirajućih maglica, kao što je Orionova maglica.
Kasnije je otkriveno, kada su vodikove spektralne linije ispitane sa vrlo visokom rezolucijom, da svaka linija ima svoj duplikat. To razdvajanje se naziva fina struktura.
Balmerova formula uredi
Balmerova formula se može iskoristiti za proračun apsorbcionih i emisionih spektralnih linija atoma vodika:
gdje je:
- - talasna dužina (ili valna duljina)
- B - konstanta sa vrijednošću 3,6456×10-7 m ili 364,56 nm.
- n - je jednak 2
- m - - cijeli broj za koji vrijedi m > n.
Godine 1888. Johannes Rydberg je iskoristio Balmerovu formula da izračuna sve spektralne linije za atom vodika, tako da je Balmerova formula specijalni slučaj Rydbergove formule:
gdje je: λ - valna duljina apsorbiranog i emitiranog svjetla, RH – Rydbergova konstanta za vodik. Rydbergova konstanta iznosi 4 / B iz Balmerove formule i ona iznosi 10 973 731,57 meter−1. [3]
Uloga u astronomiji uredi
Balmerova serija je vrlo korisna u astronomiji, jer se Balmerove linije pojavljuju u brojnim svemirskim objektima, koji imaju vodik u sebi. Spektralna klasa zvijezda, koja se prije svega zasniva na površinskim temperaturama, zasniva se na intenzitetu spektralnih linija, a Balmerova serija je za to vrlo važna.
Kako Balmerovu seriju vidimo u mnogim svemirskim objektima, često se koristi za proračun brzine kretanja tog objekta, na osnovu Dopplerovog efekta na Balmerove linije. To se često koristi za otkrivanje dvojnih zvijezda, ekstrasolarnih planeta, kao i neutronskih zvijezda i crnih rupa. Koristi se i za galaktičke skupove i zvijezdanu prašinu poslije sudara, da bi se odredila udaljenost galaksija i kvazara, na osnovu crvenog pomaka.
U zvijezdama, Balmerove linije se vide uglavnom kao apsorpcione linije, pogotovo zvijezde koje imaju površinsku temperaturu oko 10 000 K (spektralna klasa A). Kod spiralnih i nepravilnih galaksija, aktivnih galaktičkih jezgri, H II područja i planetarnih maglica, Balmerove serije su uglavnom emisione linije.
Kod zvijezdanih spektara, Balmerova linija H-epsilon (prijelaz 7-2, 397,0 nm), se često miješa sa drugom spektralnom linijom, koju stvara ionizirajući kalcij, astronomima poznata kao linija “H” (početna oznaka Fraunhoferovih linija), koja ima valnu duljinu 396,847 nm. H-zeta Balmerova linija (prijelaz 8-2) se miješa sa helijevim linijama, koje se vide kod vrućih zvijezdi.
Izvori uredi
- ↑ C.R. Nave (2006). "HyperPhysics" Hydrogen Spectrum. Georgia State University, 2008.
- ↑ "Quantum Physics" Eisberg and Resnick, John Wiley and Sons, 1985.
- ↑ [1] "CODATA Recommended Values of the Fundamental Physical Constants: 2006", Committee on Data for Science and Technology (CODATA), NIST