Izotop
Izotopi su atomi hemijskog elementa čije jezgro ima isti atomski broj, Z, ali različitu atomsku masu, A. Reč izotop, znači na istom mestu, i dolazi od činjenice da se izotopi nalaze na istom mestu u periodnom sistemu elemenata. Izotopni odnos je stalni odnos izotopa u hemijskim elementima u prirodi, i karakteristična veličina za svaku atomsku vrstu.
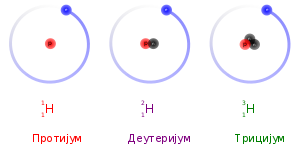

Atomski broj odgovara broju protona u atomu, Stoga izotopi datog elementa sadrže jednak broj protona. Razlika u atomskim masama potiče iz razlike u broju neutrona u atomskom jezgru. U naučnoj nomenklaturi, izotopi se označavaju imenima datog elementa iza kog sledi crtica, pa broj nukleona (protona i neutrona) u atomskom jezgru (npr., helijum-3, ugljenik-12, ugljenik-14, gvožđe-57, uranijum-238). U simboličkoj formi, broj nukleona se iskazuje iznad hemijskog simbola sa leve strane (npr., 3He, 12C, 14C, 57Fe, 238U).[1]
Izotopi svih elementa obrazuju skup nuklida. Nuklid je definicija za određeno atomsko jezgro i definiše se rednim brojem Z i masenim brojem A: AZHh (32He, 23892U) Strogo govoreći, pre bi trebalo reći da se element kao na primer fluor sastoji od jednog nuklida nego od jednog izotopa.[2]
U neutralnom atomu, broj elektrona je jednak broju protona. Stoga, izotopi datog elementa takođe imaju i isti broj elektrona i istu elektronsku strukturu. Kako je hemijsko ponašanje atoma u najvećoj meri određeno njegovom elektronskom strukturom, izotopi imaju skoro identične hemijske osobine. Glavni izuzetak je, da, usled većih masa, teži izotopi imaju tendenciju da reaguju nešto sporije od lakših izotopa. Ovaj „efekat mase“, ili izotopski efekat je najizraženiji za protijum (1H) i deuterijum (uobičajen naziv za 2H), jer deuterijum ima duplo veću masu od protiuma. Kod težih elemenata je relativna razlika u masi mnogo manja, pa je efekat mase obično zanemarljiv.
Mada izotopi imaju skoro identične elektronske i hemijske osobine, njihove nuklearne osobine se dramatično razlikuju. Atomsko jezgro se sastoji iz protona i neutrona koje na okupu drži jaka nuklearna sila. Kako su protoni pozitivno naelektrisani, oni se međusobno odbijaju. Neutroni koji su elektroneutralni prave određenu distancu između protona, redukuju elektrostatičko odbijanje i stabilizuju jezgro. Iz ovog razloga su potrebni neutroni da bi se dva ili više protona vezali u jezgro. Kako broj protona raste, potrebni su dodatni neutroni da bi se formiralo stabilno jezgro, na primer, iako je odnos neutron/proton kod 3He 1/2, neutron/proton odnos kod 238U je >3/2. Ipak, ako je prisutno previše neutrona, jezgro postaje nestabilno.
Kako izotopi datog elementa imaju različit broj neutrona, oni imaju i različit odnos neutron/proton. Ovo utiče na njihovu nuklearnu stabilnost, što rezultuje činjenicom da neki izotopi podležu nuklearnom raspadu. Raspad ovih radioaktivnih izotopa (kraće radioizotopa) je važna tema u nuklearnoj fizici. Proučavanjem načina na koji se ovaj raspad odigrava, fizičari stiču uvid u svojstva atomskog jezgra.
Obično se u prirodi može naći nekoliko izotopa istog elementa. Najčešće se javljaju stabilni izotopi, mada se mogu naći i značajne količine nestabilnih izotopa sa velikim vremenom poluraspada kao na primer uranijum-238. Male količine radioaktivnih izotopa sa malim vremenom poluraspada su takođe prisutne u prirodi. Ovi izotopi nastaju kao proizvod raspada većih radioaktivnih jezgara sa dužim životom. Atomska masa elementa u periodnom sistemu elemenata je prosek prirodne rasprostranjenosti izotopa tog elementa.
Prirodna rasprostranjenost raznih izotopa na Zemlji je u krajnjoj liniji rezultat količina izotopa formiranih u zvezdama i supernovama, kao i šema raspada radioaktivnih jezgara formiranih u ovim procesima. Zatim, formiranje sunčevog sistema je takođe značajno uticalo na proporcije različitih izotopa koji se mogu naći na Zemlji, jer su solarni vetrovi odmah po stvaranju Sunca lakše mogli da oduvaju lakša jezgra ka daljim delovima sunčevog sistema. Zbog ovoga se velike gasovite planete nalaze dalje od Sunca.
Stabilni izotopi uredi
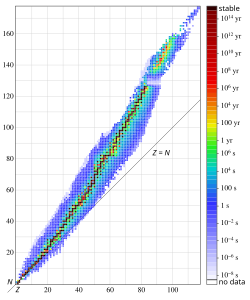
Većina hemijskih elemenata u prirodi smese su prirodnih izotopa, koji su bilo stabilni bilo radioaktivni (nestabilni). Stabilne izotope ima 81 hemijski element. To su redom svi elementi, od vodonika (Z = 1) do uključivo bizmuta (Z = 83), uz izuzetak tehnecijuma (Z = 43) i prometijuma (Z = 61). Mnogi elementi imaju više stabilnih izotopa, a to je razlog što njihove relativne atomske mase nisu celi brojevi. Vodonik je, na primer, smeša stabilnih izotopa 1H i 2H, ugljenik sadrži stabilne izotope 12C i 13C, kiseonik izotope 16O, 17O i 18O i tako dalje. Najviše stabilnih izotopa, njih 10, ima kalaj. Ukupno se u prirodi nalazi oko 270 vrsta stabilnih i oko 70 vrsta radioaktivnih nuklida.
Radioaktivni izotopi, radioizotopi (radionuklidi) pojedinih elemenata, poreklom su prirodni ili veštački. Prirodne radioizotope imaju mnogi elementi koji sadrže i stabilne izotope, a takođe i svi prirodni radioaktivni elementi, to jest oni koji ne sadrže stabilne izotope. To su elementi od polonijuma do uključivo plutonijuma (Z = 84 do 94) te element prometijum. Nuklearnim reakcijama mogu se proizvesti veštački radioizotopi gotovo svih elemenata, pa je danas poznato oko 2 500 vrsta nuklida, što prirodnih, što veštačkih. Svi se oni mogu svrstati u kartu nuklida, u kojoj je svaki nuklid prikazan kvadratom s različitim, za njega karakterističnim podatcima (izotopna obilnost, vreme poluraspada, vrsta i energija zračenja i tako dalje). Izotopi pojedinih elemenata svrstani su u vodoravnim redovima prema rastućoj masi.
Nestabilni izotopi uredi
Nestabilni izotopi, odnosno radioaktivni izotopi ili radionuklidi su atomi koji imamu odnos protona i neutrona veći ili manji od odnosa potrebnog za stabilnost. Nestabilni izotopi teže stabilnosti, a to se postiže radioaktivnim raspadom (radioaktivnost). Posledice radioaktivnog raspada je menjanje mase i/ili hemijskih svojstava radionuklida uz istodobno emitiranje jonizujućeg zračenja. Svi elementi iznad rednog broja 82 (olovo) su nestabilni jer odbojnim silama protona više nisu dovoljni neutroni kao ravnoteža. Naime, prevelika je koncentracija protona na jednom mestu.
Jezgra radionuklida se spontano raspada prelazeći pri tome u neko drugo jezgro. Prilikom raspada jezgro radionuklida emituje čestice i/ili elektromagnetne zrake kratke talasne dužine. Emitovane čestice i elektromagnetsni zraci se jednim imenom zovu jonizujuće zračenje. To je pojava radioaktivnosti, a sam proces je transmutacija, tj. spontani prelaz jednog jezgra u drugo, što se naziva radioaktivni raspad.
Nuklid je atom hemijskog elementa za koji je tačno poznat ne samo redni ili atomski broj Z, već i ukupan broj nukleona (protona i neutrona) u atomskom jezgru. U prirodi postoje samo 92 hemijska elementa i još 12 veštački proizvedenih, a poznato je oko 3 100 različitih nuklida, od kojih je 350 prirodnih i 2 750 veštačkih. Većina nuklida je nestabilna (radioaktivna), oko 2800. Pogodna kombinacija protona i neutrona čini atomsko jezgru stabilnom, čim je drugačije jezgro nastoji da se izbacivanjem nukleona približi stabilnoj konfiguraciji. Energijski nivoi u jezgru se popunjavaju kako bi se dostigla konfiguracije minimalne energije, to jest maksimalne stabilnosti.
Upotreba izotopa uredi
Postoji nekoliko primena, koje koriste svojstva različitih izotopa datog elementa. Jedna od najčešćih primena je trejser ili marker u tehnici zvanoj izotopsko obeležavanje. Izotopi datog elementa ne mogu se razlikovati međusobno hemijskim metodama. Ipak, mogu se razlikovati korišćenjem fizičkohemijskih metoda, recimo masene spektrometrije (direktne razlike u masi), infracrvene spekrtoskopije (na osnovu vibracionih frekvencija u molekulu - teži izotopi vibriraju nižim frekvencijama od lakših), nuklearne magnetne rezonancije (na osnovu različitih žiromagnetnih odnosa itd.
Primer korišćenja izotopskog obeležavanja je proučavanje fenola (C6H5OH) u vodi. Nakon dodavanja fenola deuterisanoj vodi (voda koja sadrži D2O osim uobičajenog H2O), istraživači su primetili supstituciju vodonika deuterijumom u hidroksilnoj grupi (C6H5OD), što znači da se fenol lako podvrgava reakcijama razmene vodonika sa vodom. Samo hidroksilna grupa je učestvovala u reakciji, što znači da ostalih 5 vodonikovih atoma ne učestvuju u reakcijama razmene.
Izotopska izmena se takođe može koristiti da se odrede mehanizmi reakcije putem kinetičkog izotopskog efekta (kinetic isotope effect).
Osim izotopskog obeležavanja, nekoliko vrsta spektroskopije koristi jedinstvena nuklearna svojstva posebnih izotopa. Na primer, nuklearno magnetno rezonantna (NMR) spektroskopija se može koristiti samo za izotope sa nuklearnim spinom koji nije nula (nonzero). Izotopi koji se najčešće koriste u NMR spektroskopiji su 1H, 2D, 13C, i 31P. Mesbauerova spektroskopija (Mossbauer spectroscopy) se zasniva na detektovanju nuklearnih prelaza određenih izotopa, recimo 57Fe.
Izotopski sastav elemenata se razlikuje od planete do planete. Ova činjenica omogućava da se odredi poreklo meteorita. Neki meteoriti su klasifikovani kao mesečevi ili marsovi meteoriti.
Radioaktivni izotopi takođe imaju važne primene. Razvoj nuklearne energije i nuklearnog oružja zahtevaju znatno veće količine određenih izotopa. Proces separacije izotopa predstavlja značajan tehnološki izazov.
Radioizotopi se takođe često koriste u medicini, biohemiji, i hemiji kao trejseri. Male količine radioizotopa mogu lako da se detektuju zbog karakterističnih emisija raspadajućeg jezgra.
Prirodni radioaktivni raspad 14C omogućava radiougljenično datiranje. Kosmički zraci stvaraju izotop 14C u atmosferi tako što u sudaru sa jezgrima iz vazduha izbijaju slobodne neutrone. Ti neutroni mogu jezgro azota iz molekula azota (N2) da transformišu u izotop ugljenika 14C:
- 1n + 14N → 14C + 1p
Ovaj izotop se na kraju ugradi u molekul ugljendioksida i tako dospeva u biljke, a preko njih i u životinje. Izotop 14C se, dakle, u prirodi stalno stvara (zbog kosmičkih zraka) i raspada (zbog nestabilnosti) te je njegova koncentracija u živim organizmima konstantna. Međutim, u neživom svetu nema razmene ugljendiosida te koncentracija 14C opada sa vremenom. Dakle, merenjem preostale radioaktivnosti 14C u biološkom uzorku, može da se utvrdi vreme kada je kruženje ugljenika zaustavljeno (kada je životinja uginula, drvo posečeno, biljka ubrana...).
Zbog stabilnosti i prirodne rasprostranjenosti, izotop 12C je izabran kao standard za jedinicu atomske mase, (dvanaestina mase izotopa 12C) a onda takođe u definiciji mola, u osnovnim jedinicama SI sistema.
Vidi još uredi
- Tabela izotopa (podeljena) - tabela svih poznatih izotopa
- Tabela izotopa (kompletna)
- Lista čestica
- Izotopi su nuklidi koji imaju isti broj protona; uporedi:
- Izotoni su nuklidi koji imaju isti broj neutrona.
- Izobari su nuklidi kji imaju isti maseni broj to jest zbir protona i neutrona.
- Nuklearni izomeri su različita pobuđena stanja istog tipa jezgra. Promena jednog izomera u drugi je praćena emisijom ili apsorpcijom gama zraka, ili procesom interne konverzije. (ne treba mešati sa hemijskim izomerima.)
Reference uredi
- ↑ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Arhivirano 2016-03-03 na Wayback Machine-u, 1970; probably in the 1958 first edition as well
- ↑ „NuDat 2 Description”. Arhivirano iz originala na datum 2016-12-23. Pristupljeno 2. 1. 2016.