DnaB helikaza
DnaB helikaza je bakterijski enzim koji otvara replikacionu viljušku tokom replikacije DNK. Mehanizam kojim DnaB izvodi ATP hidrolizu radi translokacije duž DNK i denaturiše dupleks nije poznat. Promena kvaternarne strukture proteina koja obuhvata dimerizaciju N-terminusnog domena je uočena i moguće je da do nje dolazi tokom enzimskog ciklusa.[1] Kad se DnaB inicijalno veže za dnaA, on se asociara sa dnaC, negativnim regulatorom. Nakon DnaC disocijacije, DnaB se vezuje za dnaG.[2]
| Replikativna DNK helikaza | |
|---|---|
| Identifikatori | |
| Simbol | dnaB |
| Entrez | 948555 |
| UniProt | P0ACB0 |
| Drugi podaci | |
| EC broj | 3.6.1.- |
| N terminalni domen DnaB slične helikaze | |
|---|---|
| |
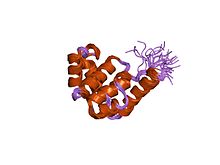
| NMR struktura N terminalnog domena E. coli DnaB helikaze | |
| Identifikatori | |
| Simbol | DnaB |
| Pfam | PF00772 |
| InterPro | IPR007693 |
| SKOP | 1jwe |
| C terminalni domen DnaB slične helikaze | |
|---|---|
| Identifikatori | |
| Simbol | DnaB_C |
| Pfam | PF03796 |
| Pfam klan | CL0023 |
| InterPro | IPR007694 |
N-terminal ima multiheliksnu strukturu koja formira ortogonalni svežanj.[1] C-terminusni domen sadrži mesto vezivanja ATP-a.
Reference uredi
- ↑ 1,0 1,1 Fass D, Bogden CE, Berger JM (June 1999). „Crystal structure of the N-terminal domain of the DnaB hexameric helicase”. Structure 7 (6): 691–8. PMID 10404598.
- ↑ Ya-Bin Lu, Pillarisetty V. A. L. Ratnakar, Bidyut K. Mohanty, and Deepak Bastia (November 1996). „Direct physical interaction between DnaG primase and DnaB helicase of Escherichia coli is necessary for optimal synthesis of primer RNA”. PNAS 93 (23): 12902-12907. Arhivirano iz originala na datum 2020-09-20. Pristupljeno 2014-01-25.
Literatura uredi
- Nicholas C. Price, Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third izd.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 izd.). Wiley-Interscience. ISBN 0471205036.
- Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 izd.). Wiley Classics Library. ISBN 0471303097.
- Robert A. Copeland (2013). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (2nd izd.). Wiley-Interscience. ISBN 111848813X.
- Gerhard Michal, Dietmar Schomburg (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd izd.). Wiley. ISBN 0470146842.